
分析 根据n=$\frac{m}{M}$计算三者物质的量之比,氮气分子含有原子物质的量为氮气的2倍,CO2、SO2分子含有原子物质的量为它们的3倍;根据n=$\frac{V}{{V}_{m}}$计算氮气物质的量,再根据V=nVm计算氮气体积.
解答 解:N2、CO2、SO2三种气体的质量比为7:11:16,则物质的量之比为$\frac{7g}{28g/mol}$:$\frac{11g}{44g/mol}$:$\frac{16g}{64g/mol}$=1:1:1,它们含原子个数比为1×2:1×3:1×3=2:3:3,
在标准状况下,4.48升N2的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量为0.2mol×28g/mol=5.6g
故答案为:1:1:1; 2:3:3; 5.6g.
点评 本题考查物质的量有关计算,比较基础,注意理解分子数目与含有原子数目关系,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度线,配制成一定物质的量浓度的溶液 | |
| B. | 向盛有NaOH的烧杯中加蒸馏水使其溶解,并立即转入容量瓶中 | |
| C. | 用托盘天平称取10.60 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| D. | 检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体分子数均为3.01×1022 | B. | 密度相等 | ||
| C. | 原子数相等 | D. | 电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )
我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )| A. | 通入O2的电极发生氧化反应 | |
| B. | 通入H2的电极是正极 | |
| C. | 正极的电极反应为O2+4H++4e-═2H2O | |
| D. | 总反应的化学方程式为:O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
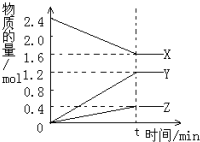 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在阴离子中,质子数一定少于核外电子数 | |
| B. | 氧化反应就是物质与氧气发生的反应 | |
| C. | 在化学反应中加入催化剂一定能加快反应的速率 | |
| D. | 最外层电子数为8的粒子一定是稀有气体元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g•L-1 |
| 排放标准 | pH 6~9 | 0.5mg•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):水、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)═SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2的键能总和大于1 mol硫和1 mol氧气的键能之和 | |
| D. | 1 mol SO2的键能总和小于1 mol硫和1 mol氧气的键能之和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com