
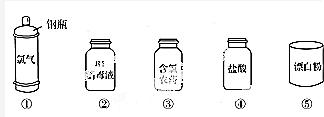
分析 (1)氯气有毒;
(2)漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2,漂白液的有效成分为NaClO;
(3)氢气与氯气反应生成HCl,溶于水得到盐酸;氯水中HClO不稳定,若变质生成盐酸,酸性增强;
(4)MnO2完全反应,根据n=$\frac{m}{M}$计算8.7g的MnO2的物质的量,再根据方程式计算氯气的体积.
解答 解:(1)氯气为有毒的气体,则①中钢瓶上应贴的标签为C,不易燃、易爆,本身不具有腐蚀性,故答案为:C;
(2)A.漂白粉的主要成分为Ca(ClO)2、CaCl2,漂白液的有效成分为NaClO,均为混合物,故A错误;
B.漂白粉的有效成分是Ca(ClO)2,含ClO-具有强氧化性,可用于漂白,故B正确;
C.石灰水的浓度较小,工业上将氯气通入石灰乳中制取漂白粉,故C错误;
D.漂白液由氢氧化钠和氯气反应生成,有效成分是NaClO,故D正确;
故答案为:BD;
(3)氢气与氯气反应生成HCl,溶于水得到盐酸,发生的反应为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;氯水中HClO不稳定,若变质生成盐酸,酸性增强,可选紫色石蕊检验,氯水、盐酸与A、B、C混合的现象均相同,不能鉴别,故答案为:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;D;
(4)8.7g的MnO2的物质的量=$\frac{8.7g}{87g/mol}$=0.1mol,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 22.4L
0.1mol V
V=$\frac{0.1mol×22.4L/mol}{1mol}$=2.24L;
故答案为:2.24.
点评 本题考查较综合,涉及物质的性质、氧化还原反应计算等,注重高频考点的考查,把握氯气的性质、氯水的成分及物质性质与用途的关系等为解答的关键,侧重分析、应用及计算能力的考查,题目难度不大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL | B. | 40mL | C. | 50mL | D. | 60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
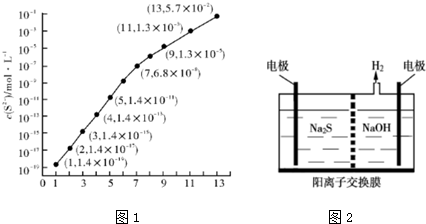
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2(CaO):HCl | B. | MgO(Al2O3):NaOH | C. | CO2(SO2):Ca(OH)2 | D. | NaCl(NH4Cl):加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com