
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
分析 A.过滤时,应避免滤纸破损;
B.过滤时,应防止滤液迸溅;
C.加热时应防止试管炸裂;
D.向试管中滴加液体时,应防止污染胶头滴管.
解答 解:A.过滤时,玻璃棒与三层滤纸的一边接触可避免滤纸破损,故A正确;
B.过滤时,漏斗下端紧贴烧杯内壁可防止滤液迸溅,故B正确;
C.酒精灯内焰温度较低,加热时应防止试管炸裂,应用外焰加热,故C错误;
D.向试管中滴加液体时,教头滴管不能插入试管内部,且应垂直悬空,以防止污染胶头滴管,故D错误.
故选CD.
点评 本题考查较为综合,涉及物质的分离、提纯、试管的加热以及药品的加入等操作,为侧重于学生的分析、实验能力的考查,注意把握实验操作的注意事项,难度不大.


科目:高中化学 来源: 题型:实验题
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
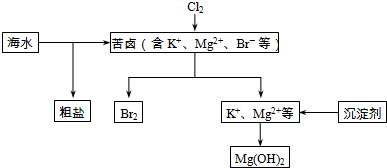
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3是两性氧化物,既能与所有的酸反应,也能与所有的碱反应 | |
| B. | 铝制容器可盛装热的浓H2SO4 | |
| C. | 明矾[KAl(SO4)2•12H2O]的水溶液能够杀菌消毒,可用做净水剂 | |
| D. | 向AlCl3溶液中加入过量氨水后,蒸干并灼烧可得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3和O2反应 | B. | NH3和HNO3反应 | C. | NO和O2反应 | D. | NH3和水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯制环己环 由氯乙烯制备聚氯乙烯 | |
| B. | 乙烯使酸性高锰酸钾褪色 乙醇制乙醛 | |
| C. | 苯和液溴在铁粉催化下反应 乙炔使溴水褪色 | |
| D. | 乙醇与浓硫酸共热制乙烯 乙醇与浓硫酸共热制乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com