
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | X、Y、W都能与氧元素形成两种氧化物 | |
| C. | W的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | W分别与X、Y形成的化合物中化学键类型相同 |
分析 短周期元素X、Y、Z、W的原子序数依次增大.X的最高正价与最低负价代数和为0,X与W所在族序数之和等于10,可知X为C,W为S;Y为金属元素,Y应位于第三周期,Y与Z最外层电子数之和与W的相等,若Y为Na,Z为P,或若Y为Mg,Z为Si,它们分别位于不同的主族,C、Si位于同主族,则Y为Na、Z为P符合,以此来解答.
解答 解:由上述分析可知,X为C,Y为Na,Z为P,W为S,
A.电子层越多,原子半价越大,同周期从左向右原子半径减小,则原子半径大小顺序:Y>Z>W>X,故A错误;
B.X、Y、W都能与氧元素形成两种氧化物,分别为CO、二氧化碳、氧化钠、过氧化钠、二氧化硫、三氧化硫,故B正确;
C.非金属性S>P,则W的最高价氧化物的水化物的酸性比Z的强,故C错误;
D.W分别与X、Y形成的化合物CS2、Na2S,化学键分别为共价键、离子键,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 煮盐的过程属于化学变化 | B. | 豆汁的主要成分为淀粉 | ||
| C. | 利用豆汁产生的泡沫除杂 | D. | 加入豆汁可以降低NaCl溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯加入到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 | |
| C. | 在洁净的试管中加入1~2mL的AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 将10%的葡萄糖溶液加入新制氢氧化铜溶液中,加热可得到砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
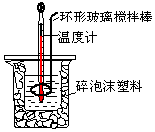 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | W | X | Y | Z | 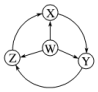 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com