
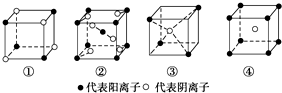
| A. | ①MR ②MR2 ③MR3 ④MR4 | B. | ①MR ②MR2 ③MR2 ④MR | ||
| C. | ①MR2 ②MR2 ③MR2 ④MR | D. | ①MR ②MR ③MR2 ④MR2 |
分析 ①中阴阳离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,阴阳离子个数之比为1:1;
②中M离子个数=1+8×$\frac{1}{8}$=2,R离子个数=2+4×$\frac{1}{2}$=4;
③中M离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,R离子个数为1;
④中M离子个数=8×$\frac{1}{8}$=1,R离子个数1;
阴阳离子个数之比等于其化学式中离子个数之比,据此判断化学式.
解答 解:①中阴阳离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,阴阳离子个数之比为$\frac{1}{2}$:$\frac{1}{2}$=1:1,其化学式为MR;
②中M离子个数=1+8×$\frac{1}{8}$=2,R离子个数=2+4×$\frac{1}{2}$=4,阴阳离子个数之比=4:2=2:1,所以其化学式为MR2;
③中M离子个数=$\frac{1}{8}$×4=$\frac{1}{2}$,R离子个数为1,阴阳离子个数之比=1:$\frac{1}{2}$=2:1,所以其化学式为MR2;
④中M离子个数=8×$\frac{1}{8}$=1,R离子个数1,阴阳离子个数之比=1:1,所以其化学式为MR;
故选B.
点评 本题考查晶胞计算,侧重考查分析计算能力,正确判断离子被几个晶胞占有是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 物质 | H2(g) | CO2(g) | CH2=CH2 | H2O(g) |
| 能量:KJ/mol | 0 | -394 | 52 | -242 |

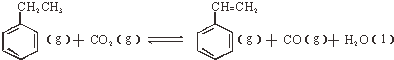 ;△H<0
;△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作食品干燥剂 | B. | 计算机芯片的主要材料是SiO2 | ||
| C. | 糖类物质都属于高分子化合物 | D. | 地沟油和矿物油都属于酯类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子中2个碳原子都是sp2杂化 | B. | 乙烯分子存在非极性键 | ||
| C. | 乙烯分子中4个H原子在同一平面上 | D. | 乙烯分子有6个σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
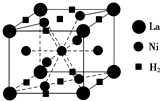 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
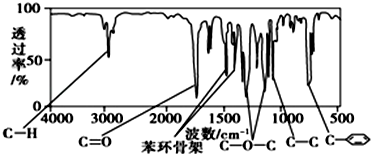
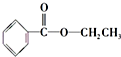 、
、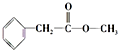 ;
;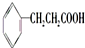 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
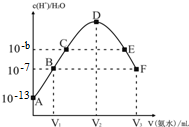
| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
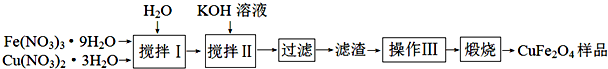

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com