
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
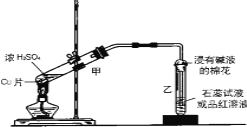
(1)写出甲装置中发生的主要反应的化学方程式____________________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________________________。
(3)生成的气体使品红溶液的颜色______________;实验完毕后,取少量乙试管中溶液于试管中加热,现象是________________;原因是__________________________________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 吸收多余的SO2防止污染环境 由红色变无色 由无色变红色 SO2漂白时生成不稳定的无色物质
CuSO4+SO2↑+2H2O 吸收多余的SO2防止污染环境 由红色变无色 由无色变红色 SO2漂白时生成不稳定的无色物质
【解析】
(1)SO2具有漂白性,能使品红溶液褪色,即乙中品红褪成无色,说明有SO2生成。铜离子在溶液中显蓝色,据此可以说明有硫酸铜生成。铜和浓硫酸反应的方程式为
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)SO2有毒,是大气污染物,需要尾气处理,因此饱和碳酸钠的作用就是吸收多余的SO2防止污染环境,故答案为:吸收多余的SO2防止污染环境。
(3)由于SO2的漂白原理是和有色物质化合生成不稳定的无色物质,在加热的条件下,又能恢复用来的颜色,所以加热时溶液由无色变红色,故答案为:由红色变无色;由无色变红色;SO2漂白时生成不稳定的无色物质。


科目:高中化学 来源: 题型:
【题目】一定量铜与100mLcmol/L的稀硝酸反应,产生1.12LNO(标准状况),反应结束后,向反应后的溶液中滴加1.0mol/L的NaOH溶液,滴加过程中,产生沉淀的质量与加入NaOH 溶液的体积关系如下图所示。

回答下列问题:
(1)写出铜与稀硝酸反应的离子方程式_____________________________________________。
(2)铜与稀硝酸反应中被还原HNO3的物质的量为________mol。
(3)铜与稀硝酸反应后的溶液中,H+的物质的量浓度为________mol/L(反应前后溶液体积变化忽略不计)。
(4)稀硝酸的物质的量浓度c=______mol/L。
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液使其全部转化为NaNO3,反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲可以判断出反应A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 图乙表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C. 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D. 图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱核磁共振、X射线行射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构、配合物结构研究等。
(1)过渡元素Cr原子的基态电子排布式为______,Cr的核外电子由激发态跃迁至基态时产生的光谱是______ (填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。

①组成该晶体的元素中电负性最大的是______,其中S的杂化类型有_______。
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为______,原因是______。
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有_________。
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_____(用离子方程式表示)。
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线行射分析其晶胞结构如图所示。

①晶胞中Na堆积形成___________(填形状)空间结构,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是__________。
②已知晶胞边长为anm,晶胞中Na的半径为bnm,则He的半径为_____nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记又追问环保局长:那么垃圾处理中,能随便焚烧吗?焚烧垃圾会降低GDP的。请问,在焚烧垃极过程中发生了
A. 不能,吸热非氧化还原反应 B. 能,吸热的氧化还原反应
C. 能,放热的非氧化还原反应 D. 不能,放热的氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是

A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 水晶、玛瑙、硅胶、硅石的主要成分都是SiO2
C. SiO2很稳定,与所有的酸都不反应
D. 单质硅可以用于计算机芯片和光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应C(s)+CO2(g)=2CO(g),下列措施能使其反应速率减小的是
A. 适当减少木炭的量 B. 将木炭块变为木炭粉
C. 加热反应物 D. 扩大反应容器的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com