
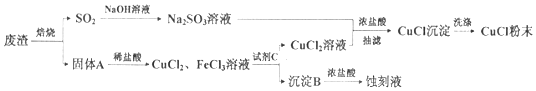
分析 用工业废渣(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液,废渣焙烧硫化亚铜生成氧化铜、二氧化硫,二氧化硫通入氢氧化钠溶液吸收得到亚硫酸钠溶液,固体A主要为氧化铜和氧化铁,加入稀盐酸溶解得到氯化铁溶液和氯化铜溶液,加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到氯化铜溶液和沉淀B为氢氧化铁,亚硫酸钠溶液和氯化铜溶液加入浓盐酸抽滤得到氯化亚铜沉淀,洗涤得到固体粉末,沉淀B是氢氧化铁,溶解于浓盐酸得到蚀刻液,以此解答该题.
解答 解:(1)提高溶解速率可以增大接触面积,把A固体粉碎,升高温度、增大盐酸的浓度等措施,
故答案为:将固体A粉碎为粉末;升高温度,增大盐酸的浓度等;
(2)由以上分析可知沉淀B为Fe(OH)3,试剂C为CuO等,起到调节pH的作用,且不引入新杂质,故答案为:Fe(OH)3;CuO;
(3)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀发生氧化还原反应,反应的离子方程式为:2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢;氯化亚铜微溶于水、不溶于乙醇,可用乙醇作为洗涤剂,
故答案为:2Cu2++SO32-+2Cl?+H2O=2CuCl↓+SO42-+2H﹢;乙醇;
(4)①空气中有氧气,在隔绝空气条件下进行时CuCl产率较高,说明CuCl能被氧气氧化,即CuCl具有还原性,
故答案为:还原;
②由于pH较高时Cu2+与碱反应生成Cu(OH)2,生成CuCl较少,所以在pH值较高时,CuCl产率较低,
故答案为:pH较高时Cu2+与碱反应生成Cu(OH)2,生成CuCl较少.
点评 本题考查了物质的分离提纯实验过程分析判断,为高考常见题型和高频考点,侧重考查学生的分析、实验能力,注意把握题干信息的应用、氧化还原反应产物的分析及其离子和化合物性质的理解应用等知识点,题目难度中等.


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:多选题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 油脂和蛋白质都属于高分子化合物 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.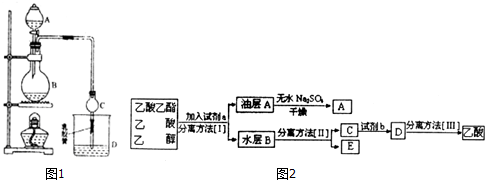
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 结论 | 原因 |
| A | 将氯气通入H2O2和NaOH的混合溶液中,导管口处发出红光,产生大量的气泡 | 该反应是放热反应,H2O2显示氧化性 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的Ksp小 |
| C | 在BaCl2和氨水混合溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com