
【题目】根据所给的实验装置,下列有关实验的相关叙述正确的是
选项 | 实验装置 | 相关叙述 |
A |
| 实验室可以用该装置和药品制取氨气 |
B |
| 反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应 |
C |
| ①中反应比②中快,说明温度升高可以加快反应速率 |
D |
| 只有氨气等极易溶于水的气体才能利用该装置形成喷泉 |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯分子中碳碳键的长度完全相等
③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷(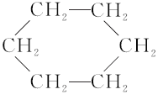 )
)
④经实验测得对二甲苯(![]() )只有一种结构
)只有一种结构
⑤苯在溴化铁作催化剂条件下同液溴可发生取代反应,但不能因化学反应而使溴水褪色
A. ②③④B. ②④⑤C. ①③⑤D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C三种有机物的相关信息:
A | ①能使溴的四氯化碳溶液褪色;②填充模型为: |
B | ①可以从煤干馏生成的煤焦油中提取;②填充模型为: |
C | 工业生产中可通过A与H2O加成获得;②相对分子质量为46 |
请结合上述信息,回答下列问题:
(1)有机物A的结构式为___________
(2)B与浓硝酸在一定条件下发生反应的化学方程式为__________
(3)有机物C的结构简式为__________。
(4)①C与乙酸反应的化学方程式为____________
②C在铜催化和加热条件下,与O2反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是石油裂解气的重要成分,由M制备环酯P的合成路线(部分反应条件略去)如图所示:

已知在特殊催化剂的作用下,能够发生碳碳双键两边基团互换的反应,如:
2CH2=CHR![]() CH2=CH2+RCH=CHR
CH2=CH2+RCH=CHR
回答下列问题:
(1)M的名称是____________,A中的含氧官能团名称是____________。
(2)①的反应类型是___________,⑥的反应类型是________________。
(3)C的结构简式为____________。由C→G的过程中步骤④、⑥的目的是___________。
(4)G中最多有_______个原子共平面,其顺式结构式为_____________。
(5)符合下列条件D的同分异构体有______种。
①氯原子连在碳链的端点碳上 ②羟基连在不同的碳原子上,其中核磁共振氢谱为4组峰且峰面积比为4:2:2:1的为__________(写结构简式)。
(6)由I和G在一定条件下制取环酯P的化学方程式为_________________。
(7)已知:  根据题中信息,设计以2-氯丙烷制备环己烯的合成路线(无机试剂和溶剂任选)___________。
根据题中信息,设计以2-氯丙烷制备环己烯的合成路线(无机试剂和溶剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质工业制法的叙述错误的是
A.陶瓷、玻璃、水泥的生产中均用到了石灰石
B.工业制备高纯硅涉及的主要反应中,所有的反应均为氧化还原反应
C.工业制硫酸过程中,常用98.3%的浓硫酸吸收SO3
D.氨催化氧化是工业制硝酸的基础
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为H2(g)和O2(g)生成H2O(g)过程中的能量变化。下列叙述中正确的是

A.该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol O(g)原子结合成O2(g)时,吸收498kJ能量
C.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(g)时,放热245kJ
D.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)时,释放的热量小于245kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:

步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______.实验中不能用干燥空气代替干燥N2,原因是______________
(2)如将装置B改为装置C(图2),可能会导致的后果是___________________
(3)步骤3中,第一次过滤除去的物质是_________________.
(4)有关步骤4的说法,正确的是__________________.
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是_____________________________.
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________________(以质量分数表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
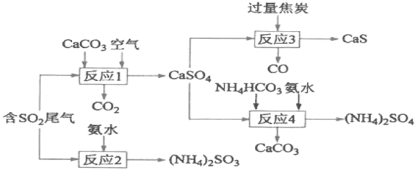
(1)反应1的化学方程式为________________;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________;
(4)整个合成路线中可以循环利用的物质是_____________;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com