
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:
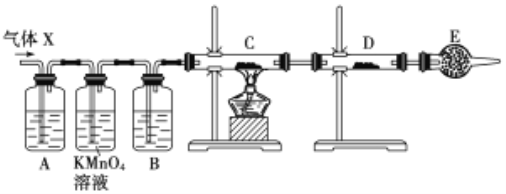
(1)配平反应的化学方程式为:___Zn + ___H2SO4(浓) = ___ZnSO4 ___SO2 ↑+ ___H2O。
(2)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(3)A中加入的试剂可能是___________溶液;
B中加入的试剂可能是____________;
C中发现黑色固体变成红色,加入的试剂可能是____________。
D中加入的试剂可能是____________。
E中加入的试剂可能是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
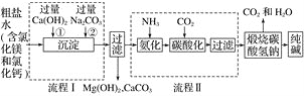
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的A、B、C、D、E五种元素,其中只有E是第四周期元素,A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)E的+2价离子基态核外电子排布式为____。
(2)A、B、C、D原子中,电负性最大的是____(填元素符号)。
(3)1 mol B2A4分子中σ键的数目为____。B4A6为链状结构,其分子中B原子轨道的杂化类型只有一种,则杂化类型为____。
(4)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子空间构型为____。
(5)E和C形成的一种化合物的晶胞结构如图所示,该化合物的化学式为____。
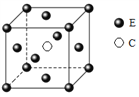
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素形成的酸有硝酸、亚硝酸(HNO2)等,其中HNO2为一元弱酸。
(1)写出HNO2溶液与NaOH溶液反应的离子方程式:___________________。
(2)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O
①用双线桥标出该反应的电子转移方向及个数。______
②该反应被氧化的元素是_____,其中被氧化的元素占该元素总量的______(填百分数)。
(3)硝酸盐可作为烟幕弹。如反应:NH4NO3+Zn=ZnO+N2↑+2H2O,反应中NH4NO3作为_____(填选项)
A.氧化剂 B.还原剂 C.既做氧化剂又做还原剂
(4)实验室需配制0.1molL﹣1的NH4NO3溶液500mL。
①配制时,应用托盘天平称取NH4NO3的质量为_________。
②配制中已有托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒,还需要的玻璃仪器有_________。
③定容时俯视刻度线,所配得溶液的浓度_____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化学物质,在生产和生活中有广泛的用途。
(1)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用氯酸钾和浓盐酸反应制备氯气的化学方程式可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中该反应的氧化剂为_____________(填化学式,下同),还原剂为_________________,若反应产生0.3mol Cl2,则消耗的还原剂的物质的量为________mol,反应转移的电子数是_______________。
(2)已知:在加热条件下,3NaClO![]() 2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
2NaCl+NaClO3.则在加热条件下,向NaOH溶液中通少量氯气时的反应方程式可表示为___________________(用一个总反应方程式表示,假设每步反应均充分进行);某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,经测定,NaClO、NaClO3的物质的量之比为4:1,则反应中被氧化的氯元素与被还原的氯元素的物质的量之比为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com