
(10分)含苯酚的工业废水的方案如下图所示:
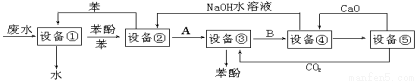
回答下列问题:
(1)设备①进行的是 操作(填写操作名称),实验室这一步操作所用的仪器是 。
(2)由设备②进入设备③的物质A是 ,由设备③进入设备④的物质B是 。
(3)在设备③中发生反应的化学方程式为 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是 、 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、 、 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是 。
①核磁共振氢谱只有一个峰 ②分子中无碳碳双键
(1)萃取 ;分液漏斗 (2)C6H5ONa;NaHCO3
(3)C6H5ONa +H2O +CO2→C6H5OH + NaHCO3 (4)CaCO3 NaOH
(5)NaOH水溶液 CO2 (6)CH3-C≡C-O-C≡C-CH3
【解析】
试题分析:(1)苯酚常温下在水中的溶解度不大,苯酚易溶于有机溶剂,设备①加入苯,分离出水,所以设备①进行分液;分液用的仪器为分液漏斗;(2)设备③中通入二氧化碳,生成苯酚,所以设备③的物质为苯酚钠;苯酚钠和二氧化碳分液生成苯酚和碳酸氢钠,化学方程式为C6H5ONa +H2O +CO2→C6H5OH + NaHCO3,所以进入设备④的物质是碳酸氢钠溶液;(4)设备④中发生的反应为: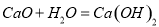 ,
,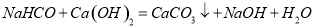 ;(5)根据上图,能循环使用的物质是C6H6、CaO、NaOH水溶液 、CO2;(6)苯酚的一种同分异构体核磁共振氢谱只有一个峰,所以分子结构对称,分子中无碳碳双键,所以结构简式为CH3-C≡C-O-C≡C-CH3 。
;(5)根据上图,能循环使用的物质是C6H6、CaO、NaOH水溶液 、CO2;(6)苯酚的一种同分异构体核磁共振氢谱只有一个峰,所以分子结构对称,分子中无碳碳双键,所以结构简式为CH3-C≡C-O-C≡C-CH3 。
考点:本题考查有机物的分离、同分异构体。


科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
阿伏加德罗常数约为6.02×1023 mol-1(NA),下列说法正确的是
A.常温常压下,16g O2与16g O3所含的原子数均是NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
C.标准状况下,2.24LCCl4所含原子数为0.5NA
D.标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol-1
2SO3(g) ΔH=?196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =?113.0 kJ·mol-1
2NO2(g) ΔH =?113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH = kJ·mol-1。
SO3(g)+NO(g)的ΔH = kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
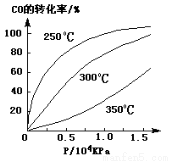
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:选择题
工业上制硫酸的第二步反应:2SO2(g)+O2(g) 2SO3(g) △H<0,反应达到平衡后,改变某一个条件,下列示意图曲线①~⑧中正确的是
2SO3(g) △H<0,反应达到平衡后,改变某一个条件,下列示意图曲线①~⑧中正确的是
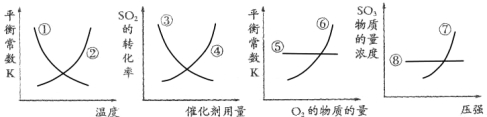
A.①⑥⑧ B.①⑤⑦ C.②③④ D.③⑥⑦
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:选择题
已知热化学方程式: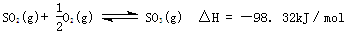 ,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
A.196.64kJ B.196.64kJ/mol
C.<196.64kJ D.>196.64kJ
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:选择题
化合物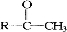 与NaOH溶液、碘水三者混和后可发生如下反应:
与NaOH溶液、碘水三者混和后可发生如下反应:
①I2 + 2NaOH  NaI + NaIO + H2O
NaI + NaIO + H2O
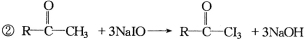
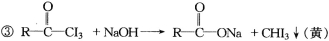
此反应称为碘仿反应,根据上述反应方程式,推断下列物质中能发生碘仿反应的有
A.CH3CH2COCH2CH3 B.CH3COCH2CH3
C.CH3CH2COOCH3 D.CH3OOCH
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 mol 甲醇中含有C-H键的数目为4NA
B.0.1mol 丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
D.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高一第一学期期中考试化学试卷(解析版) 题型:选择题
以下关于化学实验中“先与后”的说法中正确的是
①加热试管时,先均匀加热,后局部加热
②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检查装置气密性后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撒酒精灯待试管冷却后停止通H2
⑥使用托盘天平称量物体质量时,先放质量较小的砝码,后放质量较大的砝码
A.①②③⑤ B.①②④⑤⑥ C.①②③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:填空题
(16分)
(1)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: ;当 ,证明达到滴定终点。
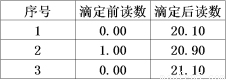
③计算: 重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为 mL,此样品的纯度为 。(已知H2C2O4的相对分子质量为90)
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管 B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com