
【题目】干电池原理如右图所示,电池总反应为Zn+2NH===Zn2++2NH3↑+H2↑。下列说法正确的是( )

A.Zn极上发生还原反应
B.碳电极上发生还原反应
C.常见锌锰干电池为二次电池
D.负极上发生的反应为2NH+2e-===2NH3↑+H2↑
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围广。请回答下列问题:
(1)制备硅半导体材料必须先得到高醇硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式 .
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种物质。写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 .
(2)下列有关硅材料的说法正确的是 (填字母)。
A.高纯度的硅,可用于生产光电池,将光能直接转换为电能
B.氮化硅硬度大.熔点高.可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料----光导纤维
D.普通玻璃是由纯碱.石灰石和石英砂制成的
E.盐酸可以与硅反应.故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃,取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中含有多种贵重金属,从中提取金、银、铂的一种工艺如下:
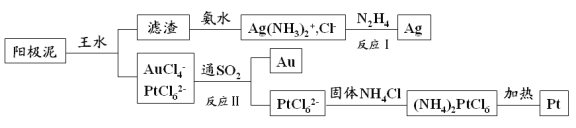
(1)王水是 的混合液,其体积比为 。
(2)滤渣的成分是 ,反应Ⅰ中肼(N2H4)的作用是 。
(3)反应Ⅱ的离子方程式为 ;当生成19.7gAu时,25℃和101kPa下反应消耗 L SO2(此条件下的气体摩尔体积为24.5L/mol,相对原子质量Au:197)。
(4)电解法精炼银时,粗银应与直流电源的 极(填“正”或“负”)相连,当用AgNO 3 和HNO 3 混合溶液做电解质溶液时,发现阴极有少量红棕色气体,则产生该现象的电极反应式为 。
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:4
C.无法确定该化合物是否含有氧元素
D.该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1 + Q2 >Q3 B.Q1 + Q2 >2Q3 C.Q1 + Q2 <Q3 D.Q1 + Q2 <2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示a,b,c,d括号内数据表示坐标。
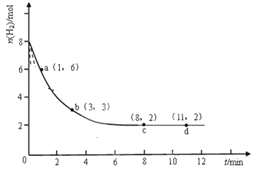
(1)0-a,a-b,b-c,c-d四段中,平均反应速率最大的时间段是 ,该时间段内H2的平均反应速率是 。
(2)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(3)平衡时CO2的转化率是 ;反应前后容器内的压强比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低。某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:

物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
Ksp | 4.0×10—38 | 5.0×10—20 | 2.0×10—16 | 8.5×10—45 | 1.2×10—23 |
请回答下列问题:
(1)固体A的主要成分是 ;加入固体B的主要作用是 。
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为 。
(3)若溶液II中c(Cu2+)为0.05mol·L—1,则溶液II的pH≤ 。
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol·L—1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是 ;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为 。
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的 杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是 。
(2)步骤②加入过量氯水的作用是___________,反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)下列操作会导致所测定的铁元素含量偏高的是______。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
(6)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 溶液,若溶液变成______色,说明该补血剂已变质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2(g)![]() N2O4(g) △H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g) △H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
(1)a、b、c、d四个点中,化学反应处于平衡状态的是 点。
(2)25 min时,增加了 (填物质的化学式) mol。
(3)a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是 (填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com