
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如图:

已知:RNH2+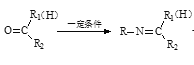 +H2O
+H2O
回答下列问题:
(1)A中官能团的名称是___,F的化学名称是__。
(2)G的结构简式为___。
(3)由C生成E,E和H生成J的反应类型分别是__、___。
(4)C和D生成E的化学方程式为___。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有___种,其中核磁共振氢谱有四组峰的结构简式为__(任写一种)
【答案】醛基 4-硝基甲苯或对硝基甲苯 ![]() 取代反应 加成反应
取代反应 加成反应 ![]() +
+![]()
![]()
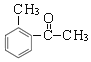 +HCl 14
+HCl 14  (任一个)
(任一个)
【解析】
A的分子式为C2H4O,能与新制氢氧化铜反应,故A为CH3CHO、B为CH3COOH。对比B、C的分子式,B中-OH被-Cl替代生成C,故C为![]() ,由J的结构,可知D中含有苯环,D发生硝化反应生成F,F中硝基被还原为氨基得到G,G与A发生信息中反应得到H,故D为
,由J的结构,可知D中含有苯环,D发生硝化反应生成F,F中硝基被还原为氨基得到G,G与A发生信息中反应得到H,故D为![]() 、F为
、F为![]() 、G为
、G为![]() 、H为
、H为![]() 。C与D反应生成E为
。C与D反应生成E为 ,E与H发生加成反应生成J。
,E与H发生加成反应生成J。
(1)A为CH3CHO,A中官能团的名称是醛基,F为![]() ,F的化学名称是4-硝基甲苯或对硝基甲苯,故答案为:醛基;4-硝基甲苯或对硝基甲苯;
,F的化学名称是4-硝基甲苯或对硝基甲苯,故答案为:醛基;4-硝基甲苯或对硝基甲苯;
(2)由分析,![]() 中硝基被还原为氨基得到G,G的结构简式为
中硝基被还原为氨基得到G,G的结构简式为![]() 。故答案为:
。故答案为:![]() ;
;
(3)D为![]() 、F为
、F为![]() 、由D生成F为甲基的对位上的氢被硝基取代的反应,H为
、由D生成F为甲基的对位上的氢被硝基取代的反应,H为![]() ,C与D反应生成E为
,C与D反应生成E为 ,E与H发生加成反应生成J,故答案为:取代反应、加成反应;
,E与H发生加成反应生成J,故答案为:取代反应、加成反应;
(4)C和D生成E的化学方程式为:![]() +
+![]()
![]()
 +HCl。故答案为:
+HCl。故答案为:![]() +
+![]()
![]()
 +HCl;
+HCl;
(5)芳香化合物K是E( )的同分异构体,K中含有苯环,若K能发生银镜反应,说明含有醛基,可以有1个取代基为-CH2CH2CHO,或者为-CH(CH3)CHO,有2种;
)的同分异构体,K中含有苯环,若K能发生银镜反应,说明含有醛基,可以有1个取代基为-CH2CH2CHO,或者为-CH(CH3)CHO,有2种;
可以有2个取代基为-CH3、-CH2CHO,或者为-CH2CH3、-CHO,均有邻、间、对3种位置结构,有6种;可以有3个取代基:2个-CH3、1个-CHO,2个甲基有邻、间、对3种位置,对应的-CHO分别有2种、3种、1种位置,有6种,故符合条件的共有2+6+6=14种,分别为: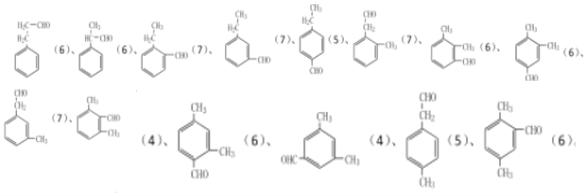 ,括号内数字为等效氢数目,其中核磁共振氢谱有四组峰的结构简式为:
,括号内数字为等效氢数目,其中核磁共振氢谱有四组峰的结构简式为: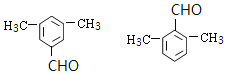 ,故答案为:14;
,故答案为:14;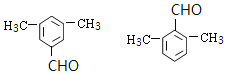 (任意1种)。
(任意1种)。


科目:高中化学 来源: 题型:
【题目】从海水中提取镁的流程如图所示(框图中是主要产物):

请回答相关问题。
(1)下列说法不正确的是____________。
A.上述方法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集![]()
C.工业上也可用电解熔融氧化镁的方法制取镁 D.电解法冶炼金属要消耗大量的电能
(2)步骤③中发生反应的离子方程是__________________________。
(3)步骤④中发生反应的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产和日常生活必须注意消防安全,下列行为不利于消防安全的是( )
A.天然气管道在输送天然气前先通入氦气
B.天然气中含“加臭剂“气体,用于警示气体泄露
C.用蘸浓氨水的棉棒检验输送氯气的管道是否泄露
D.用燃着的木条检验家用液化气钢瓶是否泄露
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
A. A、B、C、D均为气体
B. 若A、B是气体,则C、D是液体或固体
C. 温度越高,K越大
D. 在整个过程中,A的转化率一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com