
| A. | 0.5mol Na2CO3和1.6mol NaOH | B. | 1mol Na2CO3与0.6mol NaHCO3 | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 1mol Na2CO3和0.6mol NaOH |
分析 加热时碳酸氢钠分解生成二氧化碳和水,分别与过氧化钠反应生成碳酸钠和氢氧化钠,当碳酸氢钠过量时,生成二氧化碳过量,最终产物为碳酸钠.
解答 解:NaHCO3加热分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知:1mol NaHCO3分解生成0.5mol的二氧化碳、0.5mol的水和0.5molNa2CO3,生成的CO2和H2O分别与Na2O2反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,二氧化碳首先与过氧化钠反应,消耗过氧化钠0.5mol,生成碳酸钠0.5mol,还有0.3mol的过氧化钠与水反应,生成0.6mol NaOH,所以容器内残留的固体是1mol Na2CO3和0.6mol NaOH,故选D.
点评 本题考查钠的化合物的性质,题目难度不大,本题注意NaHCO3足量的特点,注意有关反应,以正确判断最终产物.


科目:高中化学 来源: 题型:解答题
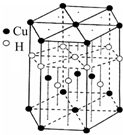 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: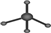 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: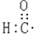 | D. | 甲醛的结构式: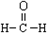 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
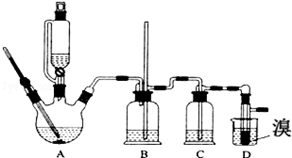
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①② | C. | 只有②③ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com