
分析 (1)Na、K均与水反应,燃烧产物与二氧化碳反应生成氧气;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0);
(3)氧化还原反应中有化合价升高的元素也有化合价降低的元素;
(4)根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,
故答案为:C;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以HClO3是氧化剂、H3PO4是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0)=20mol;
故答案为:HClO3;H3PO4;20;
(3)氧化还原反应中有化合价升高的元素也有化合价降低的元素,
A.NH4NO3→N2+O2+H2O中N元素化合价降低、O元素化合价升高,符合氧化还原反应,故A不选;
B.NH4NO3→NH3+HNO3中各元素化合价不变,符合复分解反应条件,故B不选;
C.NH4NO3→O2+HNO3+H2O中只有O元素化合价升高,所以不符合氧化还原反应,故C选;
D.NH4NO3→N2+HNO3+H2O中N元素有化合价升高的也有化合价降低的,符合氧化还原反应,故D不选;
故答案为:C;
(4)根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| B. | 常温下PH=9的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 0.1mol/LNaOH溶液中:HCO3-、Na+、K+、Ca2+ | |
| D. | 无色溶液中:H+、Cu2+、Al3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
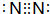 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
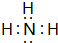 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 平衡移动的因素(填序号) | 平衡移动的方向(填序号) |
| A | ||
| B | ||
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
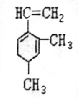 己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.
己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.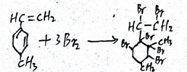 ;
;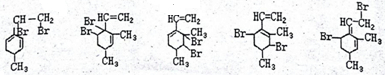 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com