
| ||
| 2min |
| 1mol |
| & |
(
| ||||
|
| 3 |
| 2.5 |
| 6 |
| 5 |
| 6 |
| 5 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л�������ΪCnH2n |
| B��һ������������������ȼ�ղ�ͨ��Ũ���ᣬ���ٵ�������������ɵ�ˮ��������� |
| C��ij��̬��CxHy������O2ǡ����ȫ��Ӧ���¶ȣ�100�棩�������Ӧǰ������������䣬��y=4 |
| D����ͬ������������ȫȼ�գ�����O2Խ�࣬���к�H��Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��4Fe��OH��2+2H2O+O2�T4Fe��OH��3 |
| B��2Fe+2H2O+O2�T2Fe��OH��2 |
| C��������Ӧ��2H2O+O2+4 e-��4OH- |
| D��������Ӧ��Fe��Fe3++3 e- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
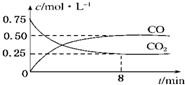 ij�¶��£���һ�ܱ������г���һ����CO2���������������ۣ�������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g�������CO2��COŨ����ʱ��ı仯��ͼ��ʾ��
ij�¶��£���һ�ܱ������г���һ����CO2���������������ۣ�������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g�������CO2��COŨ����ʱ��ı仯��ͼ��ʾ��| c(CO) |
| c(CO2) |
| �¶�/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ںϳɰ��ķ�Ӧ |
| B�����ڷ�Ӧ2HI��g��?H2��g��+I2��g��������ƽ����ϵ��ѹǿ��ѹ�����������ʹ��ϵ��ɫ���� |
| C��500�����ұ����¸������ںϳɰ���Ӧ |
| D����ѹ���������ںϳɰ���Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��H2��g��+Cl2��g��=2HCl��g������H=-a
| ||||
B��C��s��+
| ||||
| C��2H2��g��+O2��g��=2H2O��l������H=-a2H2��g��+O2��g��=2H2O��g������H=-b | ||||
| D��S��g��+O2��g��=SO2 ��g������H=-aS��s��+O2��g��=SO2 ��g������H=-b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����3m+n��mol | ||||
B����
| ||||
| C����3m+n+2p��mol | ||||
D����
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com