
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
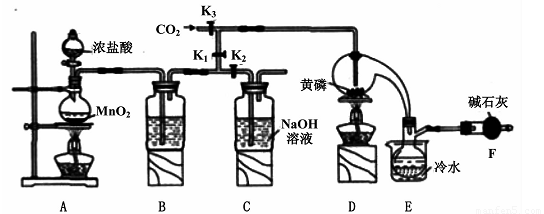
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:

请回答下列问题:
(1)A装置中制氯气的离子方程式为 ??? 。
(2)B中所装试剂是????????? ,E中冷水的作用是 ? ????????? ? ,F中碱石灰的作用是?????? 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是?? ??????????? 。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后.通过?????? (填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
 已知:?????????????????????????????????????????????????????????????????????? ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为?????????? 。
已知:?????????????????????????????????????????????????????????????????????? ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为?????????? 。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)浓H2SO4;冷凝PCl3防止其挥发;吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应
(3)排尽装置中的空气,防止白磷自燃;
(4)蒸馏
(5)79.75%
【解析】
试题分析:(1)二氧化锰和浓盐酸加热制取氯气;(2)干燥氯气用浓硫酸;根据表中PCl3的沸点可得,用冷水可以将其冷凝;根据信息可得PCl3不能遇见水蒸气,还要考虑进行尾气处理,故碱石灰的作用为吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应;(3)根据题目信息可知需要排尽装置内的空气;(4)根据题目信息可知利用沸点的不同将混合物分离,故蒸馏;(5)根据碘单质和Na2S2O3的反应求出剩余的碘单质,根据总的碘单质减去剩余的碘单质求出与H3PO3的物质的量,根据磷原子守恒得PCl3的物质的量,从而求出其质量分数。
考点:考察氯气的实验室制法、气体的干燥、根据化学方程式的计算和应用题目信息解题的能力等


科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 实验方案的设计与评价练习卷(解析版) 题型:实验题
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl,遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通入干燥CO2的作用是 。通过控制K1、K2能除去A、B装置中的空气,具体的方法是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:实验题
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
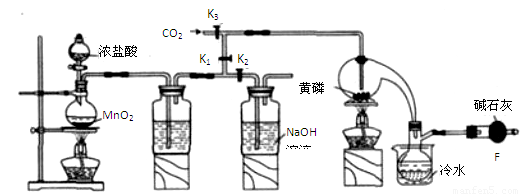
??????? A???????????? B?????????? C????????????? D?????? E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5? PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为?????????????????????????????????? 。
(2)B中所装试剂是??????????????????? ,
E中冷水的作用是 ??????????????????????????????????????????????????
F中碱石灰的作用是_____??????????????????????????????????????????????????
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 ????????????????? 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40mL
已知:H3PO3+H2O+I2== H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2012届广东省高二上学期期末学业水平测试化学试卷 题型:选择题
生产中常要控制化学反应条件增大反应速率。下列措施中不能加快化学反应速率的是
A.尽可能使用稀溶液 B.选择合适的催化剂
C.碾细固体反应物 D.提高反应体系的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com