
| A. | 检验NH4+时,加浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝,则可证明原溶液中含有NH4+ | |
| B. | 检验SO42-时,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,则可证明含SO42- | |
| C. | 用天平和小烧杯称量5.40gNaOH固体 | |
| D. | 用饱和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈红褐色即可制得Fe(OH)3胶体 |
分析 A.氨气为碱性气体,可使红色石蕊试纸变蓝;
B.不能排除SO32-和Ag+的干扰;
C.托盘天平精确到0.1;
D.向沸水中滴加FeCl3溶液并继续煮沸至液体呈透明的红褐色即可制得Fe(OH)3胶体.
解答 解:A.氨气为碱性气体,可使红色石蕊试纸变蓝,说明原溶液中一定含有NH4+,故A正确;
B.SO32-能被硝酸氧化为SO42-,并且不能排除Ag+的干扰,故B错误;
C.托盘天平精确到0.1,无法称量5.40gNaOH固体,故C错误;
D.用饱和FeCl3溶液中逐滴滴加NaOH溶液得到氢氧化铁沉淀,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的检验、仪器的使用以及胶体的制备,侧重于学生的分析能力和实验能力的考查,为高频考点和常见题型,注意把握实验的角度和可行性的评价,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加人过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向1molFeBr2溶液中通入 1.5molCl2 :2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 氯化亚铁溶液中通人氯气:Fe2++Cl2═Fe3++2C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
 ;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.
;Z的单质与W的单质一定条件下可发生反应生成化合物A,A中所含化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.| t/s | 0 | 500 | 1 000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
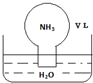
| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为$\frac{1}{22.4}$ mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 所得溶液中,n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com