
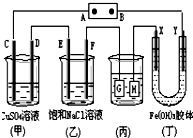
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
分析 A.根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极;
B.电解池中带正电荷的微粒向阴极移动,带负电荷的微粒向阳极移动;
C.电镀时,镀层作阳极,镀件作阴极,电解质溶液中金属阳离子与阳极材料是相同的元素;
D.甲装置中C电极上氢氧根离子放电,D电极上铜离子放电,E电极上氯离子放电,F电极上氢离子放电,根据得失电子和生成物的关系式计算.
解答 解:A.根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,故A错误;
B.丁装置中Y电极是阴极,如果Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷,故B正确;
C.若用(丙)装置给铜镀银,G应该是Ag,H是铜,电镀液是AgNO3溶液,故C错误;
D.甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的C、D、E、F电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol铜时需要2mol电子,生成1mol氯气时需要2mol电子,生成1mol氢气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2:2:2,故D正确;
故选BD.
点评 本题考查了电解池原理,能正确判断电解池的阴阳极是解本题的关键,明确电泳现象证明了胶粒带电.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是2 | B. | 电子数是2 | C. | 质量数是3 | D. | 中子数是1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
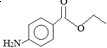 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| C. | 苯环上有2个取代基,且含有硝基的同分异构体有15种 | |
| D. | 分子式为C9H10NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素单质是导体 | |
| B. | 该元素单质在一定条件下能与盐酸反应 | |
| C. | 该元素的氧化物的水合物显碱性 | |
| D. | 该元素的最高价氧化物对应的水化物为两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
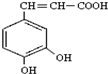 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效. .写出咖啡酸与NaHCO3溶液反应的方程式::
.写出咖啡酸与NaHCO3溶液反应的方程式::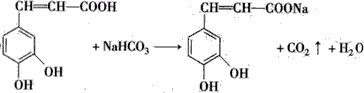 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O42-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com