
| A、化学式:NH3 |
B、电子式: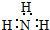 |
C、结构式: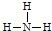 |
D、比例模型: |
 ,故B错误;
,故B错误; ,故C正确;
,故C正确; ,故D正确;
,故D正确;

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B、当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C、原稀硝酸的物质的量浓度一定为4mol/L |
| D、参加反应金属总质量(m)为9.6g>m>3.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
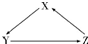 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )| 选项 | X | Y | Z |
| A | SiO2 | H2SiO3 | Na2SiO3 |
| B | Na | Na2O2 | NaOH |
| C | H2SO3 | SO2 | H2SO4 |
| D | HClO | Cl2 | HCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验拟作 | 实验目的或结论 |
| A | 向某溶液中加人稀盐酸,放出无色剌激性气味气 体.将气体通人澄清石灰石灰水变混浊 | 证明该格液中存在SO 32- |
| B | 将NaOH溶液滴人该溶液中加热?放出的气体能使湿润的红色石蕊试纸变蓝 | 证明溶液中有NH4+ |
| C | 将Cl2,通人品红溶液中,品红溶液褪色 | 证明Cl2的还性 |
| D | 用毓酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明氧化性:H2O2比Fe3+ 强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含一种分子的物质是纯净物,只含一种元素的物质也是纯净物 |
| B、酸的分子式中有几个氢就是几元酸 |
| C、金刚石、石墨、C60互为同素异形体 |
| D、C、N、O三种元素的第一电离能:C<N<O;电负性:C<N<O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Zn与足量任意浓度的硫酸反应转移电子数均是2NA |
| B、在常温常压下1molC7H16中含有共价键的总数目是23NA |
| C、0.1molFeCl3完全水解生成Fe(OH)3胶体粒子数目为0.1NA |
| D、33.6L 盐酸在标准状况下所含有HCl分子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA |
| B、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] |
| C、一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
| D、电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
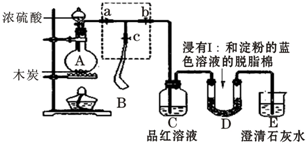
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 |
| B、反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2 |
| C、混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量少 |
| D、混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com