
分析 Ⅰ.观察到有无色气泡产生说明乙二酸与碳酸氢钠反应生成二氧化碳,说明乙二酸的酸性比碳酸强,由于乙二酸过量,故生成NaHC2O4;
Ⅱ.①高锰酸钾本身有颜色,可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫红色,故不需要另加指示剂;
②依据5H2C2O4 +2MnO4-+6H+=10CO2↑+2Mn2++8H2O计算乙二酸的浓度,乙二酸具有还原性;
Ⅲ.根据反应物的量判断生成物,根据生成物的性质来分析溶液呈酸性的原因,两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度.
解答 解:Ⅰ.向盛有1mL饱和NaHCO3溶液的试管中加入过量乙二酸溶液,观察到有无色气泡产生,说明乙二酸与碳酸氢钠反应生成二氧化碳,说明乙二酸有酸性,其酸性比碳酸强,由于乙二酸过量,故生成NaHC2O4,该反应的离子方程式为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;有酸性,其酸性比碳酸强;
Ⅱ.①原乙二酸溶液无色,而KMnO4为紫红色,滴定终点时,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色由无色变成紫红色,且半分钟不变化,证明达到终点,所以不需要另加指示剂,
故答案为:不需要;
②乙二酸(H2C2O4)与酸性高锰酸钾溶液发生氧化还原反应,乙二酸被氧化成二氧化碳,高锰酸钾被还原成锰离子,反应的离子方程式为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O,滴加0.1000mol•L-1的酸性高锰酸钾溶液滴至20.00mL时,溶液恰好变色,则25.00mL溶液中含H2C2O4的物质的量为:0.1mol/L×20.00mL×$\frac{5}{2}$,此乙二酸的浓度为$\frac{0.1mol/L×20.00mL}{25.00mL}$×$\frac{5}{2}$=0.2mol/L,高锰酸钾中锰的化合价降低,乙二酸中碳的化合价升高,所以乙二酸具有还原性,
故答案为:0.2000; 还原性;
Ⅲ.2.52g草酸晶体的物质的量=$\frac{2.52g}{126g/mol}$=0.02mol,100mL 0.2mol/L的NaOH溶液中氢氧化钠的物质的量=100mL×10-3L/mL×0.2mol/L=0.02mol;
所以反应生成NaHC2O4,所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性,
故答案为:反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性.
点评 本题考查溶液的配制、乙二酸的性质,溶液配制关键清楚溶液配制的原理,理解实验原理,掌握氧化还原滴定原理与应用是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将铜粉与硫粉混合均匀加热以制取CuS | |
| B. | 将铜丝插入浓硫酸中并加热,反应后再加水以观察CuSO4溶液的颜色 | |
| C. | 向CuSO4溶液中加入过量的NaOH溶液,过滤洗涤并收集沉淀充分灼烧以制取CuO | |
| D. | 向淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2并加热,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 | |
| D. | 将AgCl加入到较浓的KI溶液中,AgCl能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
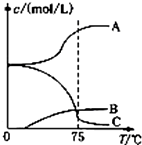 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH固体称量时间过长 | B. | 盛放标准盐酸的滴定管用碱液润洗 | ||
| C. | 用酚酞作指示剂 | D. | 固体NaOH中含有Na2O杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
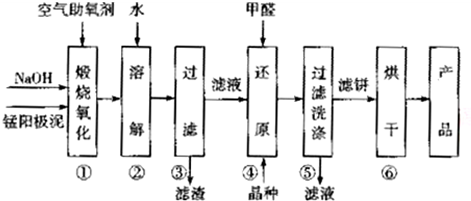
| 物质 | MnSO4 | Mn(OH)2 | MnO2 |
| 溶解性或Ksp | 易溶 | 1.9×10-13 | 难溶 |
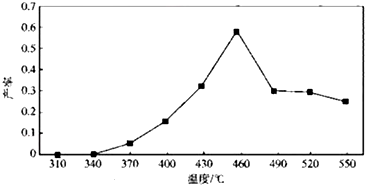
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com