
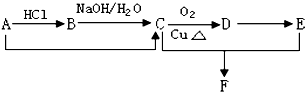
分析 (I)有机物A的分子式是C2H4,则A为CH2=CH2,乙烯与HCl发生加成反应生成B为CH3CH2Cl,氯乙烷水解生成C为CH3CH2OH,乙醇催化氧化生成D为CH3CHO,乙醛进一步氧化生成E为CH3COOH,乙醇与乙酸发生酯化反应生成F为CH3COOCH2CH3;
(II)(1)乳酸与氢氧化钠或碳酸钠等反应生成CH3CH(OH)COONa,再与钠反应生成CH3CH(Na)COONa;
(2)乳酸的同分异构体满足:可以发生银镜反应,说明含有醛基,1mol该物质能跟金属钠反应产生1molH2,说明还含有2个羟基.
解答 解:(I)有机物A的分子式是C2H4,则A为CH2=CH2,乙烯与HCl发生加成反应生成B为CH3CH2Cl,氯乙烷水解生成C为CH3CH2OH,乙醇催化氧化生成D为CH3CHO,乙醛进一步氧化生成E为CH3COOH,乙醇与乙酸发生酯化反应生成F为CH3COOCH2CH3.
(1)由上述分析可知,B的结构简式为CH3CH2Cl,D的结构简式为:CH3CHO,
故答案为:CH3CH2Cl;CH3CHO;
(2)A→B属于加成反应,C+E→F属于酯化反应或取代反应,
故答案为:加成反应;酯化反应或取代反应;
(3)C+E→F的反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(II)(1)乳酸与氢氧化钠或碳酸钠等反应生成CH3CH(OH)COONa,再与钠反应生成CH3CH(Na)COONa,
故答案为:氢氧化钠或碳酸钠;钠;
(2)乳酸的同分异构体满足:可以发生银镜反应,说明含有醛基,1mol该物质能跟金属钠反应产生1molH2,说明还含有2个羟基,符合条件的同分异构体为:HOCH2CH(OH)CHO,
故答案为:HOCH2CH(OH)CHO.
点评 本题考查有机物推断、有机物结构与性质、限制条件同分异构体书写等,涉及烯烃、醇、醛、羧酸、酯的性质等,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
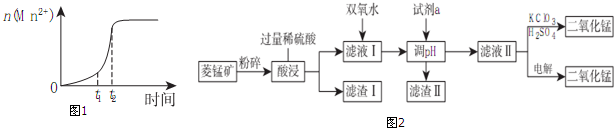
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 | |
| B. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
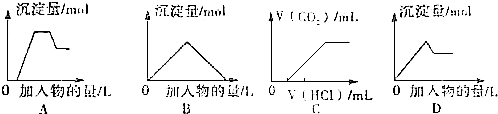
| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com