
分析 (1)自来水中水的沸点较低;
(2)利用盐酸排除干扰离子,再加氯化钡检验硫酸根离子;
(3)上下两层均无色,但水层再加少量水不出现分层,以此来解答.
解答 解:(1)自来水中水的沸点较低,则实验室通过蒸馏方法除去自来水中的Cl-等杂质,制取蒸馏水,故答案为:蒸馏;
(2)鉴定某溶液中含有SO42-的实验步骤、现象和结论取待测液1-2ml于试管中,然后滴入足量的稀盐酸,再向酸化后澄清的溶液中滴入几滴氯化钡溶液,若有白色沉淀生成,则说明有硫酸根,反之则没有;硫酸钠溶液作该项鉴定所发生的化学反应方程式是Na2SO4+BaCl2=BaSO4↓+2NaCl,
故答案为:取待测液1-2ml于试管中,然后滴入足量的稀盐酸,再向酸化后澄清的溶液中滴入几滴氯化钡溶液,若有白色沉淀生成,则说明有硫酸根,反之则没有;Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)上下两层均无色,但水层再加少量水不出现分层,则用实验方法知道那一层是水层,设计一种最简便的判断方法为打开分液漏斗上口瓶盖,在向其加入少量蒸馏水,观察加入的蒸馏水与哪层液体相溶,
故答案为:打开分液漏斗上口瓶盖,在向其加入少量蒸馏水,观察加入的蒸馏水与哪层液体相溶.
点评 本题考查混合物分离提纯及检验,为高频考点,把握混合物分离提纯原理、离子及物质的检验等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
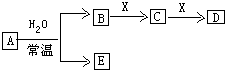 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去). ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下1molSO3的体积为22.4L | B. | 标准状况下CO2的密度比SO2大 | ||
| C. | 1molSO42-的质量为94g | D. | 1molOH-含有10mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
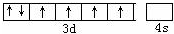 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
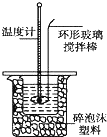 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com