
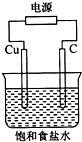
| A. | 石墨电极与直流电源负极相连 | |
| B. | 铜电极的反应式为:2H++2e-═H2↑ | |
| C. | 氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 | |
| D. | 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
分析 氯碱工业原理:阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,根据电极反应结合图象分析.
解答 解:氯碱工业原理:阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,由图可知Cu为阴极(若铜为阳极,则铜失电子,氯离子不反应),C为阳极,
A、石墨为阳极,与直流电源的正极相连,故A错误;
B、Cu为阴极,阴极上氢离子得电子生成氢气,铜电极的反应式为:2H++2e-═H2↑,故B正确;
C、Cu为阴极,阴极上氢离子得电子生成氢气,同时生成氢氧化钠,电解池中阳离子向阴极移动,Na+向Cu电极移动,故C错误;
D、Cu为阴极,阴极上氢离子得电子生成氢气,没有氯气生成,所以用湿润KI淀粉试剂在铜电极附近检验气体,试纸不变蓝色,故D错误.
故选B.
点评 本题考查了电解原理的应用,侧重于电极的判断和电极方程式的书写的考查,题目难度不大,注意把握氯碱工业的原理.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量的两种盐与足量盐酸反应,在相同条件下Na2CO3产生的CO2的体积小 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 | |
| D. | 等物质的量浓度的两种溶液,Na2CO3溶液的pH大于NaHCO3溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
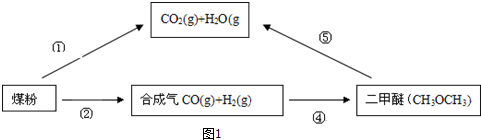
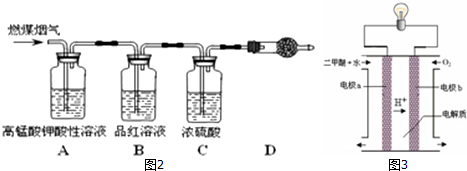
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳光通过门缝有光亮通路 | |
| B. | 一支钢笔使两种不同牌号的墨水,容易出现堵塞 | |
| C. | 向氯化铁溶液中加 NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
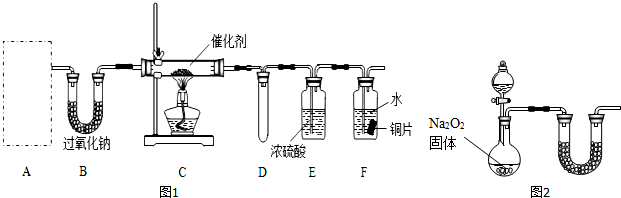
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.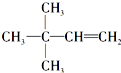 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.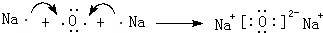 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com