
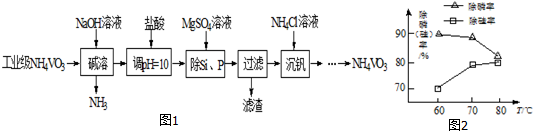
分析 以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵,
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,据此答题;
(2)根据Ksp[Mg3(PO4)2]=c3(Mg2+)c2(PO43-),结合c(PO43-)≤10-6 mol•L-1进行计算;
(3)根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子;
(4)反应温度需控制在50℃可以用水浴,探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等;
(5)高纯的偏钒酸铵灼烧生成V2O5,根据元素守恒可知,还应有氨气和水产生,据此书写化学方程式;
解答 解:以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵,
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,故选a,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,故选c,
故答案为:ac;
(2)根据Ksp[Mg3(PO4)2]=c3(Mg2+)c2(PO43-)可知,当c(PO43-)=10-6 mol•L-1时,c(Mg2+)=$\root{3}{\frac{6.4×10{\;}^{-26}}{(10{\;}^{-6}){\;}^{2}}}$=4×10-5mol•L-1,
故答案为:4×10-5;
(3)根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子,所以升温促进Mg2+水解生成Mg(OH)2,使硅酸根水解生成硅沉淀,反应的离子方程式为SiO32-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3↓+2OH-(或者SiO32-+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$H4SiO4↓+2OH-),
故答案为:升温促进Mg2+水解生成Mg(OH)2;SiO32-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3↓+2OH-(或者SiO32-+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$H4SiO4↓+2OH-);
(4)反应温度需控制在50℃可以用水浴加热,探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等,所以要 向A中加入约9 mL蒸馏水,使两份溶液总体积相等,
故答案为:50℃水浴加热;A中加入约9 mL蒸馏水,使两份溶液总体积相等;
(5)高纯的偏钒酸铵灼烧生成V2O5,根据元素守恒可知,还应有氨气和水产生,反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2 NH3↑+H2O,
故答案为:2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2 NH3↑+H2O.
点评 本题考查了制备实验方案的设计,涉及到氧化还原反应、盐类的水解原理的应用、实验方案的完善等,难度中等,侧重对学生分析问题的能力考查.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的比例模型: | |
| B. | 过氧化氢的电子式: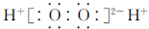 | |
| C. | 氟原子的结构示意图: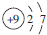 | |
| D. | H2CO3的电离方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )
分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )| A. | 该图表示的是乙烯分子的球棍模型 | |
| B. | 该烃分子是非极性分子 | |
| C. | 该烃的电子式为: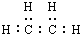 | |
| D. | 该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置制备Fe(OH)2并能较长时间观察其颜色 | |
| B. |  用装置制备并收集少量氨气 | |
| C. |  用装置除去H2S中的水蒸气 | |
| D. |  用装置制取纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
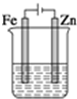
| A. | 溶液中氯离子向锌电极移动 | B. | 锌电极上生成氧化产物 | ||
| C. | 两端电极产生相等体积的气体 | D. | 电路中电子转移数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 空气中直径小于或等于2.5?m的颗粒物称为PM2.5 | |
| C. | pH<7的雨水称为酸雨,对环境造成很大的危害 | |
| D. | 甲醛的水溶液可以作为鱿鱼等海鲜的防腐剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com