
实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
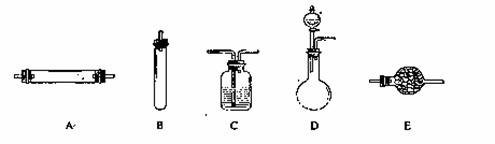
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.
科目:高中化学 来源: 题型:
0.1 mol·L-1NaOH溶液和0.1 mol·L-1NH4C1溶液等体积混合,离子浓度大小正确的是
A.c(Na+)>c(C1-)>c(OH-)>c(H+)
B.c(Na+)=c(C1-)>c(OH-)>c(H+)
C.c(Na+)=c(C1-)>c(H+)>c(OH-)
D.c(C1-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:_________ ____ __ 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是 _________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列括号内杂质的试剂或方法错误的是
A. HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.Fe2+ (Fe3+),还原铁粉,过滤
C.NaHCO3溶液(Na2CO3);通入过量的CO 2
D.CO2(HCl),饱和溶液,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
某些化学反应可用表示(未配平): ;请回答下列问题:
;请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,写出该反应的离子方程式:_________________________________________________。
(2)若A为紫红色金属,D为无色刺激性气体,请写出符合上式的化学方程式:
______________________________________________________________。
(3)若C、D均为气体(其中C有颜色)且分子具有相同的原子个数比,则符合上式化学方程式是:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中导电性最强的是
A.5L 0.1mol / L NH3·H2O B.5L 0.2mol / L 盐酸
C.0.1L 0.1mol / L 醋酸溶液 D.0.1L 0.1mol / L NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A + B=3C + 4D的反应中,下列表示该反应的化学反应速度最快的是
A.v (A)=0.5 mol/(L·s) B.v (B)= 0.3 mol/(L·s)
C.v (C)=0.8 mol/(L·s) D.v (D)=1.0 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1) 配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯和玻棒外,还需要用到的主要仪器有__________,__________;
(2) 滴定过程:
①盛装0.10 mol/L的盐酸标准液应该使用_______滴定管;
②滴定时双眼应注意观察___________________________________;
(3) 误差讨论:(选填“偏高”、“偏低”或“无影响” )
① 用蒸馏水冲洗锥形瓶,测定结果__________;
② 在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果__________;
③ 读数时,滴定前仰视,滴定后俯视,测定结果____________;
④ 装标准液之前,没有用标准液润洗滴定管,测定结果____________;
(4) 有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
计算纯度:烧碱样品的纯度是____________(取两次实验所耗盐酸的平均值进行计算,不写计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷中的碳原子是sp3杂化,下列用*表示碳原子的杂化和甲烷中的碳原子杂化状态一致的是 ( )
A.CH3C*H2CH3 B.C*H2=CHCH3
C.CH2=C*HCH3 D.CH2=CHC*H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com