
分析 (1)硫酸根离子与钡离子反应生成沉淀,且除杂不能引入新杂质;
(2)含有Ca2+、Mg2+、SO42-等杂质,最后除去钙离子,则碳酸钠应在氢氧化钡之后,在HCl之前;
(3)都是最后加入盐酸,可除去过量的碳酸钠并调节pH.
解答 解:(1)欲除去SO42-必须加入可溶性的钡试剂,不能选择B,因加入Ba(NO3)2会引入杂质NO3-,后续反应难以除去,
故答案为:B;加入Ba(NO3)2会引入杂质NO3-;
(2)Mg2+、SO42-的除杂没有先后,最后除去钙离子,则碳酸钠应在氢氧化钡之后,在HCl之前,则加入试剂的顺序不合理的是C,故答案为:C;
(3)都是最后加入盐酸,其作用为调节溶液的pH,除去溶液中的杂质CO32-、OH-,发生CO32-+2H+═H2O+CO2↑、OH-+H+═H2O,
故答案为:CO32-+2H+═H2O+CO2↑;OH-+H+═H2O.
点评 本题考查物质的分离提纯及除杂等,为高频考点,把握除杂中试剂的加入顺序及碳酸钠在氢氧化钡之后,在HCl之前为解答的关键,侧重粗盐提纯的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| 编号 | 实验 | 操作 |
| A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中. |
| B | 除去BaSO4中的少量BaCO3 | 加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
| C | 量取盐酸溶液 | 用25mL量筒量取4.0mol/L的盐酸5.62mL |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(E) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(E) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(T1)>K(T2) | |
| C. | T2温度下10min内,平均速率为v(E)=0.020mol•L-1•min-1 | |
| D. | T1温度下达到平衡后,再充入0.50mol E和1.0mol F,达到新平衡时E的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
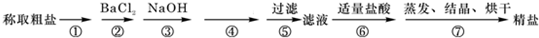
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
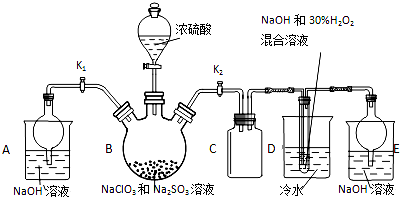 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氟丙烷(C3F8)与全氟甲烷(CF4)互为同系物 | |
| B. | 石墨能导电,所以石墨属于电解质 | |
| C. | 在化学反应中,原子的种类和数目均保持不变 | |
| D. | 干冰的气化、煤的气化均属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
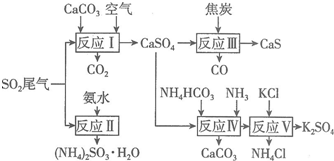
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com