
| A. | HBO2 | B. | H2BO3 | C. | H3BO3 | D. | H2B4O7 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
 催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、CO${\;}_{3}^{2-}$ | B. | Na+、I-、Cl-、OH- | ||
| C. | NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、K+、OH- | D. | Na+、Al3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO4 H2SO4 H3PO4 H4SiO4 | B. | H2SO4 H2SO3 HNO3 HNO2 | ||
| C. | HClO4 HClO3 HClO2 HClO | D. | HClO4 H2SO4 H2SO3 H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过量的氢气与氮气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H2和C6H6 | B. | C2H4和C3H8 | C. | C2H4和C3H6 | D. | C3H6和C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
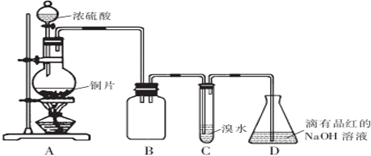
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液呈紫色 | Ⅰ或者Ⅲ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com