ClO
2是一种黄绿色气体,易溶于水.实验室以NH
4Cl、盐酸、NaClO
2(亚氯酸钠)、为原料制备ClO
2的流程如图:
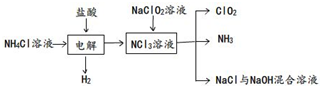
(1)写出电解时发生反应的化学方程式:
.
(2)除去ClO
2中的NH
3可选用的试剂是
(填写字母).
A.碳酸钠溶液 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO
2的过程如下:在锥形瓶中加入足量的碘化钾,用50mL水溶解,再加3mL硫酸溶液,将生成的ClO
2气体通入锥形瓶中完全吸收,在锥形瓶中加入几滴淀粉溶液,用0.10mol/L的硫代硫酸钠标准液滴定(I
2+2S
2O
32-=2I
-+S
4O
62-),共用去50.00mL标准液.
①ClO
2通入锥形瓶中与酸性碘化钾溶液反应(还原产物为Cl
-),反应的离子方程式
;
②滴定终点现象是
;
③测得ClO
2的质量m(ClO
2)=
;
(4)以N
2、H
2为电极反应物,以1L浓度均为0.05mol?L
-1的HCl-NH
4Cl混合液为电解质溶液的燃料电池,请写出电池工作时的正极反应式:
.已知NH
3?H
2O在常温下的电离平衡常数为K,N
2-H
2燃料电池工作一段时间后溶液的pH=7,求电路中通过的电子的物质的量为
(用含K的代数式表示,假设NH
3与H
2O完全转化为NH
3?H
2O且忽略溶液体积的变化). 若有3克H
2被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO
4溶液,(假设以石墨为电极,整个过程中能量总利用率为80%),若要将CuSO
4溶液恢复到原来的浓度,需加入
(填化学式),质量为:
.




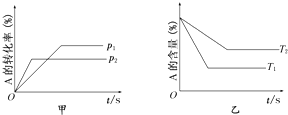
 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题: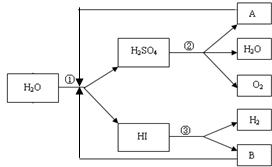 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程: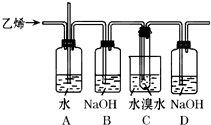 已知1,2-二溴乙烷的主要物理性质如表:
已知1,2-二溴乙烷的主要物理性质如表: