
| A. | 按系统命名法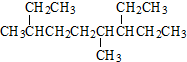 的名称为:4,7-二甲基-3-乙基辛烷 的名称为:4,7-二甲基-3-乙基辛烷 | |
| B. | 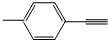 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 肌醇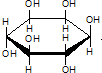 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 | |
| D. | 1.0 mol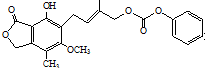 最多能与含5 mol NaOH的水溶液完全反应 最多能与含5 mol NaOH的水溶液完全反应 |
分析 A、此命名不符合取代基的位次最小;
B、苯环左侧为甲基,甲基为四面体结构;
C、根据结构式书写化学式,环上没有标注元素符合的交点为碳原子,肌醇属于醇,不属于糖类;
D、1mol该物质水解,左边的酯基1水解生成1mol羧基,右边的酯基水解生成2mol羧基,实际生成1molH2CO3,同时生成1mol苯酚,分子中还含有1mol酚羟基能与氢氧化钠反应,羧基、酚羟基与氢氧化钠都按1:1反应.
解答 解:A、取代基的位次不是最小,应是为3,6-二甲基-7-乙基壬烷,故A错误;
B、苯环左侧为甲基,甲基为四面体结构,甲基中的三个H与苯环不可能全部共平面,故B错误;
C、二者化学式均为C6H12O6,满足Cm(H2O)n,肌醇属于醇,不属于糖类,葡萄糖属于糖类,选项中结葡萄糖为吡喃式构形,故C错误.
D、1mol该物质水解,左边的酯基1水解生成1mol羧基,右边的酯基水解生成2mol羧基,实际生成1molH2CO3,同时生成1mol苯酚,分子中还含有1mol酚羟基能与氢氧化钠反应,羧基、酚羟基与氢氧化钠都按1:1反应,故1mol该物质最多能与5mol氢氧化钠反应,故D正确;
故选D.
点评 本题考查烷烃的命名、有机物结构与性质、官能团性质等,难度中等,D为易错点,容易忽略右边的酯基水解会生成苯酚.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程产生的气体体积(在标准状况下)为5.6 L | |
| B. | 电解过程只发生了2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 | |
| C. | 电解过程转移的电子数为3.612×1023个 | |
| D. | 加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
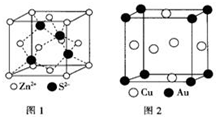 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8 等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 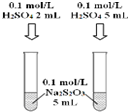 可以探究H2SO4浓度对反应速率的影响 | |
| B. | 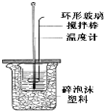 用于测定中和热时应该用稍过量的NaOH溶液和盐酸反应 | |
| C. | 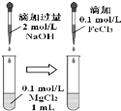 可以探究Mg(OH)2能否转化成Fe(OH)3 | |
| D. | 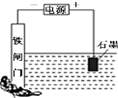 中金属防护方法叫做牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 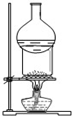 用于I2与NH4Cl混合物的分离 | B. |  可用于制取及观察Fe(OH)2 | ||
| C. | 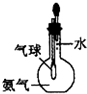 验证氨气易溶于水 | D. | 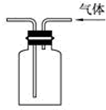 可用于排空气法收集CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
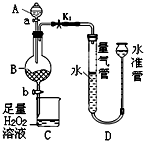 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁属于电解质,工业上可用电解其溶液的方法制镁 | |
| B. | 钠钾合金的硬度小,可用作快中子反应堆的热交换剂 | |
| C. | Fe2O3是红棕色固体,可以制成红色的油漆、涂料 | |
| D. | 溴单质在CCl4中的溶解度大,可用CCl4萃取Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
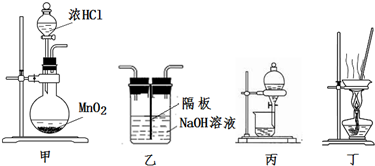
| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com