
| A. | 100℃纯水在pH=6,所以水在100℃时呈酸性 | |
| B. | pH=3的盐酸溶液,稀释至10倍后pH>4 | |
| C. | 0.2mol•L-1的醋酸与等体积水混合后pH=1 | |
| D. | pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
分析 A.纯水无论温度如何变化始终显中性;
B.盐酸是强酸溶液,溶液稀释10倍,PH增大一个单位;
C.醋酸是弱酸,存在电离平衡,加水稀释促进其电离;
D.pH=3的盐酸溶液中氢离子浓度为10-3mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度为$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,等体积混合后生成氯化钠溶液,溶液呈中性.
解答 解:A.加热促进水的电离,氢离子和氢氧根离子浓度都同等程度增大,纯水始终显中性,故A错误;
B.盐酸溶液是强酸溶液,pH=3的盐酸溶液,稀释至10倍后pH=4,故B错误;
C.醋酸溶液中存在电离平衡,加水稀释促进其电离,与等体积水混合后pH>1,故C错误;
D.pH=3的盐酸溶液中氢离子浓度为10-3mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度为$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,等体积混合后生成氯化钠溶液,溶液呈中性,PH=7,故D正确;
故选D.
点评 本题考查了水的电离平衡影响因素分析,溶液PH计算,注意弱电解质电离平衡的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应放热使其熔化而发生爆炸 | |
| B. | 钠与水生成的氢气燃烧而发生爆炸 | |
| C. | 钠失去电子,正电荷堆积的斥力将钠变为针状碎片的结果 | |
| D. | 钠与水反应产物使溶液碱性增强让反应更加剧烈而发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇的分子数为NA | |
| B. | 1mol甲基中含有的电子数为10NA | |
| C. | 13g乙炔和苯的混合气体中含有原子总数为2NA | |
| D. | 1L 0.1mol•L-1乙酸溶液中H+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体在一定条件下能稳定存在 | |
| B. | 胶体带电荷,而溶液呈电中性 | |
| C. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| D. | 可以利用过滤的方法分离胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\frac{\underline{\;[O]\;}}{\;}$
$\frac{\underline{\;[O]\;}}{\;}$ +
+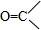
 +H2O→
+H2O→ +HCl
+HCl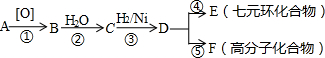
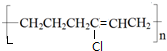 、BOHCCH2CH2CH2CH2COCl、EOHCCH2CH2CH2CH2COOH
、BOHCCH2CH2CH2CH2COCl、EOHCCH2CH2CH2CH2COOH +nH2O,缩聚反应.
+nH2O,缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸不慎溅到皮肤上,应立即用大量水冲洗 | |
| B. | BaCO3,BaSO4都难溶于水,均可用作钡餐 | |
| C. | 除铁锈是利用硫酸的酸性氧化铁反应 | |
| D. | 过量的SO2与氢氧化钠稀溶液反应的离子方程式为SO2+2OH-═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,0.1mol•L-1盐溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 相同条件下,与HCl反应的剧烈程度:Na2CO3<NaHCO3 | |
| D. | 等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的质量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com