
【题目】铅蓄电池的总反应式为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O据此判断下列叙述正确的是( )
2PbSO4+2H2O据此判断下列叙述正确的是( )
A.放电时,H2SO4浓度增加
B.放电时,负极的电极反应式为:Pb+SO42﹣﹣2e﹣═PbSO4
C.在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸
D.在充电时,阴极发生的反应是PbSO4﹣2e﹣+2H2O═PbO2+SO42﹣+4H+
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】现有下列仪器:烧杯、铁架台(带铁圈)、三脚架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是( )
A. 萃取B. 蒸发C. 分液D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为
A. 1-1.75a% B. 1.75a% C.1.25a% D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是什么?举例说明胶体的应用。
________________________,_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。
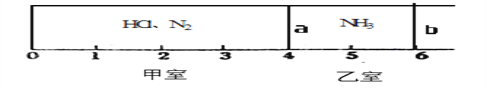
(1)甲室中HCl、N2的质量之比为__________________。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________”处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶液的密度/gcm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1molL-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________molL-1。
(3)将物质的量浓度分别为c2molL-1和0.2c2molL-1的氨水等质量混合,所得溶液的物质的量浓度__________0.6c2molL-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( ) 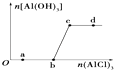
A.a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C.c点对应的溶液中:K+、Ag+、Ca2+、NO3﹣
D.d点对应的溶液中:K+、NH4+、CO32﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过利用如图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物 
请分析:
(1)Ⅰ.装置B的作用装置D的作用
Ⅱ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(2)若按假设2进行,反应方程式为
(3)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:得出结论:假设2成立
C中的固体配成溶液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
该方案是否合理(填“是”或“否”),理由是
(4)若假设2成立,反应前后C管增加6.4g,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧原子的质最为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是( )
A.该氧原子的摩尔质量为 ![]() g/mol
g/mol
B.1 mol 该氧原子质量为幽a NAg
C.xg 该氧原子所含的电子数为 ![]()
D.yg 该氧原子的中子数一定为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH) 的制备流程如图: 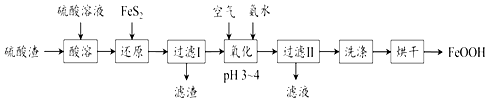
已知:FeS2难溶于水,不与H2SO4反应,在“还原”步骤中,Fe3+通过反应Ⅰ、Ⅱ被FeS2还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+;反应Ⅱ中氧化产物为单质硫.
(1)“酸溶”中硫酸要适当过量,目的是:①提高铁的浸出率;② .
(2)写出酸溶时硫酸渣中主要成分发生反应的一个化学方程式: .
(3)加入FeS2“还原”时反应Ⅱ的离子方程式为 . 滤渣的主要成分是FeS2、S和(填化学式)
(4)“氧化”时,生成FeOOH的离子方程式为 . 氧化时,温度不宜过高,否则会导致产品颜色偏红,可能含有的杂质是(填化学式).
(5)滤液中溶质是Al2(SO4)3和(填化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com