
分析 (1)在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质,无论电解质还是非电解质,都一定为化合物,据此进行解答;
(2)依据稀释前后溶质的物质的量不变,溶液具有均一性,与体积无关;
(3)①溴化亚铁中通入足量的氯气,氯气氧化亚铁离子和溴离子分别生成铁离子和溴单质;
②向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,发生KAl(SO4)2+2Ba(OH)2═2BaSO4↓+KAlO2+2H2O,以此来解答.
解答 解:(1)①Na是金属,既不是电解质也不是非电解质;
②盐酸是混合物,既不是电解质也不是非电解质;
③酒精不能电离,属于非电解质; ④CO2 本身不能电离,属于非电解质;
⑤NH3 本身不能电离,属于非电解质;
⑥Cu(OH)2为碱,属于电解质;⑦Ba(OH)2为碱,属于电解质;⑧冰醋酸(纯净的醋酸),为弱酸,属于电解质;
⑨蔗糖不能电离,属于非电解质;
⑩NaCl溶液为混合物,既不是电解质也不是非电解质;
⑪BaSO4为盐,属于电解质,故答案为:⑥⑦⑧⑪;③④⑤⑨;
(2)溶液稀释前后所含溶质的物质的量不变,设稀释后溶液的浓度为C,则:0.01mol•L-1×V=C×2V,解得C=0.005mol/L,溶液具有均一性,与体积无关,所以取10ml后溶液的浓度仍然是0.005mol/L,盐酸为强酸,氢离子浓度等于盐酸浓度,故答案为:0.005mol/L;
(3)①通入足量氯气,亚铁离子、溴离子均全部被氧化,离子反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
②向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,1molKAl(SO4)2需要消耗2molBa(OH)2,则发生KAl(SO4)2+2Ba(OH)2═2BaSO4↓+KAlO2+2H2O,故答案为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O.
点评 本题考查了电解质与非电解质的判断、溶液的稀释、离子反应方程式的书写等,题目难度浓度不大,明确电解质的概念、电离方程式的书写方法是解题关键,注意溶液稀释规律.


科目:高中化学 来源: 题型:填空题
 .乙烯的电子式是
.乙烯的电子式是 .将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5
.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5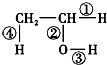 在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.
在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | 二氧化碳 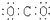 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①⑤⑦ | C. | ③④⑤⑥ | D. | ②③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
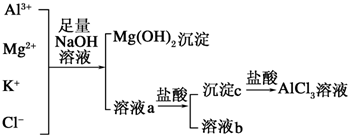
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
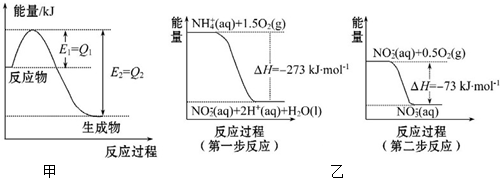
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com