Ⅰ.设反应①Fe(s)+CO
2(g) )

FeO(s)+CO(g);△H=Q
1的平衡常数为 K
1,反应②Fe(s)+H
2O(g)

FeO(s)+H
2(g);△H=Q
2的平衡常数为K
2,在不同温度下,K
1、K
2的值如下:
| T/K |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是
吸
吸
(填“放”或“吸”)热反应.
(2)现有反应③H
2(g)+CO
2(g)

CO(g)+H
2O(g);△H=Q
3平衡常数为K
3.
根据反应①与②推导出K
1、K
2、K
3的关系式K
3=
;
可推断反应③是
吸
吸
(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有
DE
DE
.
A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q
1、Q
2、Q
3的关系式Q
3=
Q1-Q2
Q1-Q2
.
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O
2、MnO
4-、H
2O、Mn
2+、H
2O
2、H
+.已知该反应中H
2O
2 只发生了如下过程:H
2O
2→O
2.
(1)该反应应选择的酸是:
C
C
(填序号).
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
MnO4-
MnO4-
→
Mn2+
Mn2+
.
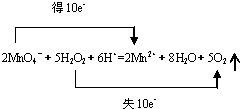
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
0.6
0.6
mol.
(5)H
2O
2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H
2O
2+H
2O═A+NH
3↑,试指出生成物A的化学式为
KHCO3
KHCO3
.
(6)H
2O
2还有“绿色氧化剂”的美称,阐明H
2O
2被称为绿色氧化剂的理由是
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
.



 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案 FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下: CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.