
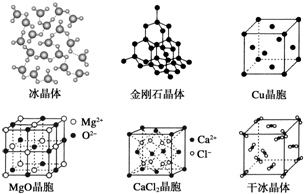
分析 (1)原子晶体中粒子之间以共价键结合,离子晶体中粒子之间为离子键,分子晶体中粒子之间为范德华力,金属晶体中粒子之间为金属键;
(2)根据均摊法计算MgO晶胞中Mg2+数目,Cu晶胞中Cu原子数目;
(3)离子电荷越多、半径越小,晶格能越大;
(4)Ca2+位于晶胞的面心与顶点,利用均摊法计算;CaCl2晶体中Cl-的配位数为4,由化学式可知CaCl2晶体中Ca2+的配位数为Cl-的配位数的2倍;
(5)冰中水分子间形成氢键,冰的熔点远高于干冰的.
解答 解:(1)图中各晶体,只有金刚石为原子晶体,粒子之间以共价键结合,
故答案为:金刚石晶体;
(2)MgO晶胞中Mg2+位于棱上与体心,晶胞中Mg2+数目为1+12×$\frac{1}{4}$=4,Cu晶胞中Cu原子位于顶点与面心,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:4;4;
(3)MgO中阴阳离子半径小,所带电荷数多,所以晶格能大,
故答案为:小于;MgO中阴阳离子半径小,所带电荷数多,所以晶格能大;
(4)Ca2+位于晶胞的面心与顶点,每个CaCl2晶胞中实际占有Ca2+ 离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,CaCl2晶体中Cl-的配位数为4,由化学式可知CaCl2晶体中Ca2+的配位数为Cl-的配位数的2倍,故Ca2+的配位数为8,
故答案为:4;8;
(5)冰中水分子间形成氢键,冰的熔点远高于干冰的,
故答案为:冰中水分子间形成氢键.
点评 本题考查晶胞计算、晶体离子与性质、氢键等,掌握均摊法进行晶胞有关计算,注意氢键对物质性质的影响.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气在常温下是气体,而磷单质是固体 | |
| B. | N2在空气中不能燃烧,而磷能在空气中燃烧 | |
| C. | NH3极易溶于水,而PH3难溶于水 | |
| D. | 硝酸比磷酸酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 溴单质与水的反应比氯单质与水的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
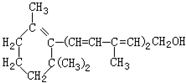
| A. | 维生素A的分子式为C16H25O | |
| B. | 维生素A含有苯环结构 | |
| C. | 维生素A的一个分子中有3个双键 | |
| D. | 维生素A的分子中含有两种官能团 (维生素A的结构简式) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com