
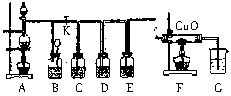
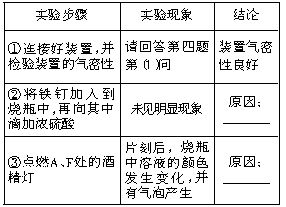
三、②铁遇浓硫酸发生钝化,阻止了铁与浓硫酸继续反应 ③加热使铁表面的氧化物薄膜被破坏并发生反应,溶液中有铁离子生成,并伴随有二氧化硫气体产生
四、(1)将装置G中导管口浸没在水面以下,关闭分液漏斗活塞,打开活塞K,微热装置A,装置G中导管内有气泡冒出;关闭K,装置B长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气
(2)2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(3)碱液;防止多余的二氧化硫逸出污染环境
(4)D
五、(1)装置A中浓硫酸在加热条件下与铁反应逐渐变为稀硫酸,此时发生反应:Fe+H2SO4=FeSO4+H2↑,生成的H2经过F装置还原氧化铜:H2+CuO Cu+H2O
Cu+H2O
(2)将铁钉放置在冷的浓硫酸中浸泡一段时间后,取出铁钉置于硫酸铜溶液中,观察铁钉表面是否有红色物质析出,若析出红色物质,则表明在不加热条件下铁在浓硫酸中没有发生钝化,否则,铁在浓硫酸中发生了钝化


科目:高中化学 来源: 题型:阅读理解
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气
(2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
(2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
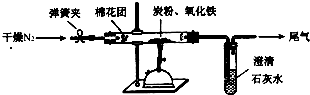 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com