
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
| A. | 340K时,速率表达式中m=1 | |
| B. | 340K时,速率表达式中k正≈0.35min-1 | |
| C. | 340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.035mol.L-1.min-1 | |
| D. | 若t=2min时升高温度,则m不变,k正减小 |
分析 A.由表中数据可知,c(N2O5)浓度之比等于v正之比,v正与 c(N2O5)浓度成正比关系;
B.v正与 c(N2O5)浓度成正比关系,则m=1,由任意一组数据根据v正=k正.c(N2O5)计算k正;
C.根据v正=k正.c(N2O5)计算;
D.升高温度,反应速率加快,k正是与温度有关的常数,不影响m值,根据v正=k正.c(N2O5)判断.
解答 解:A.由表中数据可知,c(N2O5)浓度之比等于v正之比,则v正与 c(N2O5)浓度成正比关系,故m=1,故A正确;
B.v正与 c(N2O5)浓度成正比关系,则m=1,由2min数据可知,0.028mol.L-1.min-1=k正×0.080mol.L-1,解得k正≈0.35min-1,故B正确;
C.340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.35min-1×0.35min-1=0.035mol.L-1.min-1,故C正确;
D.升高温度,反应速率加快,k正是与温度有关的常数,不影响m值,根据v正=k正.c(N2O5)可知k正增大,故D错误,
故选:D.
点评 本题考查化学反应速率,侧重考查学生对数据的分析归纳,B选项中可以多次计算求平均值以减小误差.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
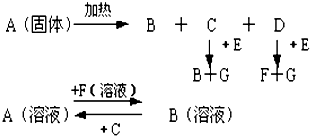
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(NH4+)+c(NH3)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-) | |
| B. | c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(H2PO4-)+c(HPO42-)+c(PO43-) | |
| C. | c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)+c(NH3•H2O) | |
| D. | c(H3PO4)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)=0.100mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
,加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com