
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .写出C与NaOH水溶液共热反应的化学方程式
.写出C与NaOH水溶液共热反应的化学方程式 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O.
+2NaBr+H2O.分析 A苯环上只有一个取代基,A的相对分子质量不超过150,完全燃烧只生成CO2和H2O且分子中氧元素的质量分数为12%,则含氧原子个数为$\frac{150×12%}{16}$=1,含C原子应为9个,A能够与银氨溶液反应,说明A分子中含有醛基,B能够与溴的四氯化碳反应且1molB能够与1mol氢气发生加成反应,说明B中含有1mol碳碳双键,则A中含有1mol碳碳双键,A的分子式为C9H8O,B结构简式为 ,B与Br2发生碳碳双键上的加成反应生成的C为
,B与Br2发生碳碳双键上的加成反应生成的C为 ,C在NaOH的醇溶液中加热发生消去反应生成的D中含有碳碳三键,1molD再与2mol氢气发生加成反应生成苯丙酸,据此分析.
,C在NaOH的醇溶液中加热发生消去反应生成的D中含有碳碳三键,1molD再与2mol氢气发生加成反应生成苯丙酸,据此分析.
解答 解:A苯环上只有一个取代基,A的相对分子质量不超过150,完全燃烧只生成CO2和H2O且分子中氧元素的质量分数为12%,则含氧原子个数为$\frac{150×12%}{16}$=1,含C原子应为9个,A能够与银氨溶液反应,说明A分子中含有醛基,B能够与溴的四氯化碳反应且1molB能够与1mol氢气发生加成反应,说明B中含有1mol碳碳双键,则A中含有1mol碳碳双键,A的分子式为C9H8O,B结构简式为 ,B与Br2发生碳碳双键上的加成反应生成的C为
,B与Br2发生碳碳双键上的加成反应生成的C为 ,C在NaOH的醇溶液中加热发生消去反应生成的D中含有碳碳三键,1molD再与2mol氢气发生加成反应生成苯丙酸,
,C在NaOH的醇溶液中加热发生消去反应生成的D中含有碳碳三键,1molD再与2mol氢气发生加成反应生成苯丙酸,
(1)A的分子式为C9H8O,A能够与银氨溶液反应,说明A分子中含有醛基,B能够与溴的四氯化碳反应且1molB能够与1mol氢气发生加成反应,说明B中含有1mol碳碳双键,故答案为:C9H8O; 碳碳双键、醛基;
(2)B与Br2发生碳碳双键上的加成反应生成的C为 ,C在NaOH的醇溶液中加热发生消去反应生成的D中含有碳碳三键,
,C在NaOH的醇溶液中加热发生消去反应生成的D中含有碳碳三键,
故答案为:加成反应;消去反应;
(3)反应⑤是 与氢气发生加成反应,化学方程式为
与氢气发生加成反应,化学方程式为 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ ,C为
,C为 ,C在NaOH的水溶液中加热发生取代反应的化学方程式为
,C在NaOH的水溶液中加热发生取代反应的化学方程式为 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O,
+2NaBr+H2O,
故答案为: +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ ;
; +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O;
+2NaBr+H2O;
(4)B结构简式为 ,其同分异构体①遇FeCl3溶液显紫色,说明含有酚羟基;②能发生银镜反应,说明含有醛基;③分子中含碳碳双键结构,若其只有2个取代基,则可以分别为-OH和-CH=COOCH,临间对3种,分别为-OH和-C(OOCH)=CH2,临间对3种,若其有3个取代基,可以分别为-OH、-CHO和-CH=CH2,按定一移二法,假设-OH和-CH=CH2在临位,则-CHO在苯环上还有4个位置,有4种同分异构体,假设-OH和-CH=CH2在间,则-CHO在苯环上还有4个位置,有4种同分异构体,假设-OH和-CH=CH2在对位,则-CHO在苯环上还有2个位置,有2种同分异构体,所以,B的符合条件的同分异构体共有16种,故答案为:16.
,其同分异构体①遇FeCl3溶液显紫色,说明含有酚羟基;②能发生银镜反应,说明含有醛基;③分子中含碳碳双键结构,若其只有2个取代基,则可以分别为-OH和-CH=COOCH,临间对3种,分别为-OH和-C(OOCH)=CH2,临间对3种,若其有3个取代基,可以分别为-OH、-CHO和-CH=CH2,按定一移二法,假设-OH和-CH=CH2在临位,则-CHO在苯环上还有4个位置,有4种同分异构体,假设-OH和-CH=CH2在间,则-CHO在苯环上还有4个位置,有4种同分异构体,假设-OH和-CH=CH2在对位,则-CHO在苯环上还有2个位置,有2种同分异构体,所以,B的符合条件的同分异构体共有16种,故答案为:16.
点评 本题是典型的有机推断题,关键是据已知条件推断出A的结构,难点是同分异构体的书写,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由该氯原子构成氯分子(Cl2)的相对分子质量为$\frac{24a}{b}$ | |
| B. | mg该氯原子的物质的量为$\frac{m}{aNA}$ mol | |
| C. | ng该氯原子所含的电子数为$\frac{17n}{aNA}$ | |
| D. | 1mol该氯原子的质量为aNA g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 葡萄糖能发生氧化反应和银镜反应 | |
| C. | 乙醇和乙酸都能与氢氧化钠反应 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,原物质一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:
某兴趣小组同学研究了氧族元素及其某些化合物的部分性质,查阅资料如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
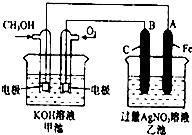 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
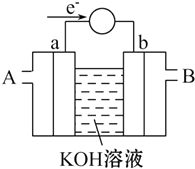 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com