
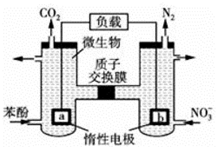
| A. | a电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| B. | 电子流向为a→负载→b→质子交换膜→a | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 当有1mol电子转移时,正极产生2.24L气体 |
分析 b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,a电极是负极,发生失电子的氧化反应,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,
A、a电极是负极发生氧化反应;
B、原电池中电子从负极流向正极,据此回答;
C、原电池中阳离子从负极移向正极;
D、b极上N元素的化合价降低,所以b是正极发生还原反应,根据电极反应式进行计算.
解答 解:A、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,a电极是负极,发生失电子的氧化反应,电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+,故A正确;
B、原电池中电子从负极流向正极,只能经过导线,不能经过电解质,即电子流向为a→负载→b→,故B错误.
C、原电池中阳离子从负极移向正极,即H+由左室通过质子交换膜进入右室,故C错误;
D、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,当有1mol电子转移时,正极产生标况下的2.24L气体,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
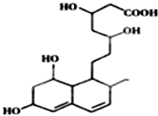
| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
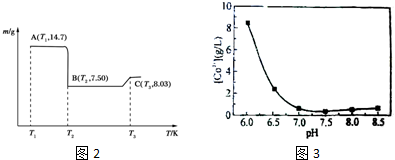
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+4H++2MnO4-═5SO42-+2Mn2++2H2O | |
| D. | 向AlCl3溶液滴入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
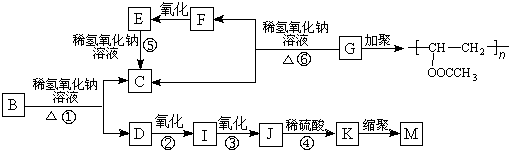
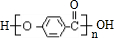 .
.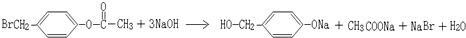 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: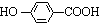 +NaOH→
+NaOH→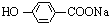 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
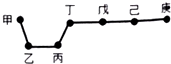
| A. | 单质甲与单质乙充分反应一定都可以生成多种化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊>丁 | |
| C. | 可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质 | |
| D. | 因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的$\frac{2}{3}$处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
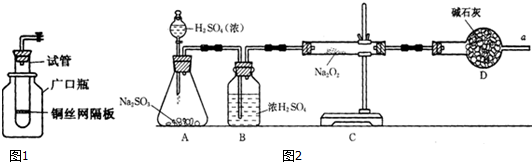
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com