
〔化学—选修5:有机化学基础〕
物质H俗称农康酸,是制备高效黏合剂等多种精细化学品的重要原料,可经下列反应路线得到:
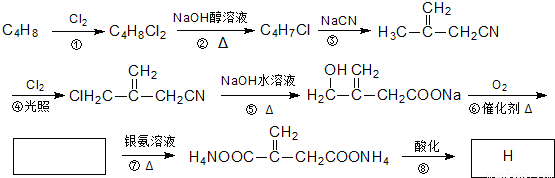
回答下列问题:
(1)C4H8的名称(系统命名)是____________;C4H7Cl中含有的官能团的名称是____________。
(2)反应⑥的化学方程式为______________;其反应类型为_____________;?的反应类型____________。
(3)衣康酸有多种同分异构体,其中与衣康酸属于同类且核磁共振氢谱有5个峰的有机物的结构简式为______________________。
(4)下列关于H的说法正确的是_________(填字母)。
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1 mol H完全燃烧消耗5 mol O2
科目:高中化学 来源:2017届湖南省岳阳市华容县四校高三联考二化学试卷(解析版) 题型:选择题
卫生部发生公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )

A.CaO2具有氧化性,对面粉可能具有漂白作用
B.CaO2中阴阳离子的个数比为1: 1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2===2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
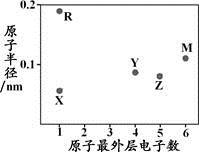
下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:选择题
下列实验方案中,能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 | 检验乙烯、乙炔混合气中的乙烯 |
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:选择题
常温下,关于pH = 2的盐酸,下列说法不正确的是
A.溶液中c(H+)=1.0ⅹ10-2mol·L-1
B.此溶液中由水电离出的c(OH-)=1.0ⅹ10-12mol·L-1
C.加水稀释100倍后,溶液的pH=4
D.加入等体积pH=12的氨水,溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2017届西藏林芝一中高三上学期月考一化学试卷(解析版) 题型:选择题
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
下列有关香叶醇的叙述正确的是( )
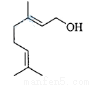
A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色 D.能发生加成反应不能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2017届湖南湖南省长沙市高三月考试卷三化学试卷(解析版) 题型:选择题
具有对称结构的姜黄素有抗氧化、保肝护肝、抑制肿瘤生长等功能。它的一种合成路线如图所示:
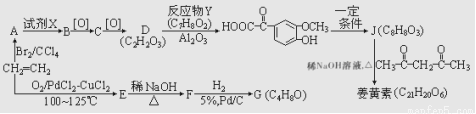
已知:①E、G能发生银镜反应;
②R—CHO+R'—CH2—CHO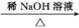
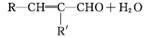 (R、R'表示烃基或氢)。
(R、R'表示烃基或氢)。
③
请回答下列问题:
(1)G的名称是 ;D中所含官能团的名称是 。
(2) A生成B的反应类型是 。
(3)据最新报道,乙烯与双氧水在催化剂作用下反应生成B,产率较高。写出该反应的化学方程式: 。
(4)姜黄素的结构简式为 。
(5)在J的同分异构体中,同时满足下列条件的同分异构体有 种。
A.既能发生水解反应,又能发生银镜反应;
B.遇氯化铁溶液发生显色反应。
(6)参照上述流程,以苯乙烯为原料,设计路线制备某药物中间体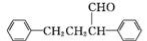 : 。
: 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南湖南省长沙市高三月考试卷三化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用的叙述都正确的是
A.明矾溶液具有强氧化性,可用作净水剂
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
D.常温下,铝能被浓硝酸钝化,可用铝制槽车运送浓硝酸
查看答案和解析>>
科目:高中化学 来源:2017届江苏省徐州、宿迁、连云港、淮安四市高三11月模拟化学卷(解析版) 题型:填空题
FeCl3可用作印刷电路铜板腐蚀剂和外伤止血剂等
(1)若要溶解电路板上3.2g的铜,则至少需要1 mol·L-1 FeCl3溶液的体积为 mL。
(2)检验腐蚀电路铜板后的溶液中是否存在Fe3+的试剂是 。
(3)腐蚀电路铜板后的溶液中铜元素含量的测定:
取20.00mL腐蚀电路铜板后的溶液于碘量瓶中,先加足量NaF(发生的反应为Fe3++6F-=[FeF6]3-),再加足量的10%KI溶液,摇匀。塞上碘量瓶瓶塞,置于暗处5min,充分反应后(有CuI沉淀生成),加几滴淀粉溶液,用0.1000 mol·L?1Na2S2O3标准溶液滴定到终点时,共消耗20.00mL标准液。测定过程中有关物质的转化关系如下:
若测定过程中碘量瓶敞口置于暗处5min,会导致测定结果 (填:“偏高”、“偏低”、“无影响”)。
计算该腐蚀液中铜元素的含量(用g·L?1表示),写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com