
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+ 的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是
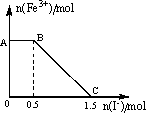
A.图中AB段发生的是过量的酸性KMnO4溶液与KI的反应
B.从题中可以得出还原性:I->Fe2+>Mn2+
C.取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色
D.根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol
D
【解析】当加入KI时,Fe3+的量开始一段时间不变,是因为I- 还原了剩余的MnO4-,故氧化性:MnO4->Fe3+,A说法正确;然后Fe3+的物质的量不断减少,说明I- 还原了Fe3+,故氧化性:Fe3+>I2;故还原性:I->Fe2+>Mn2+,B说法正确。BC段为Fe3+与Fe2+的混合液,故可用KSCN溶液检验,C说法正确。据电子守恒有MnO4-~~5I-,故剩余的KMnO4的物质的量为0.1mol,据电子守恒有MnO4-~~5Fe2+~~5Fe3+~~5I-,故与Fe2+的KMnO4的物质的量为0.2mol,故原来KMnO4的物质的量为0.3mol,D说法错误。


科目:高中化学 来源: 题型:
“张-烯炔环异构反应”被《Name Reactions》收录。该反应可高效构筑五元环化合物:

(R、R‘、R“表示氢、烷基或芳基)
合成五元环有机化合物J的路线如下:
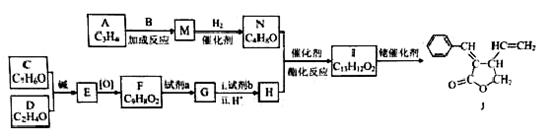
已知: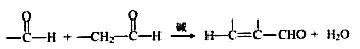
(1)A属于炔烃,其结构简式是 。
(2)B由碳、氢、氧三种元素组成,相对分子质量是30。B的结构简式是
(3)C、D含有与B相同的官能团,C是芳香族化合物,E中含有的官能团是
(4)F与试剂a反应生成G的化学方程式是 ;试剂b是 。
(5)M和N均为不饱和醇。M的结构简式是
(6)N为顺式结构,写出N和H生成I(顺式结构)的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:NiCl2+2e-===Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为
M(s)+R(g) X(g)+Y(g)
X(g)+Y(g)  ;所得实验数据如下表所示:
;所得实验数据如下表所示:
| 实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
| ① | 300 | 2.00 | 2.80 |
| ② | 400 | 2.00 | 3.00 |
| ③ | 400 | 4.00 | a |
下列推断正确的是
A.上述反应中,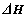 <0
<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4 min达到平衡,0~4 min内υ(X)=0.2mol•L1•min1
D.实验③中a=6.00
查看答案和解析>>
科目:高中化学 来源: 题型:
浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半。若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2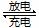 4LiCl+S+SO2。下列说法不正确的是
4LiCl+S+SO2。下列说法不正确的是
A.Li为电池的负极
B.电池的电解液可用LiCl水溶液代替
C.放电时电子从负极经外电路流向正极
D.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
[有机化学基础]
颠茄酸酯(J)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,其合成路线如下:
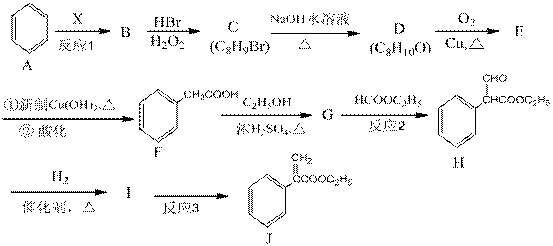
回答下列问题:
(1)烃B中含氢的质量分数为7.69%,其相对分子质量小于118,且反应1为加成反应,则B的分子式为___________,X的化学名称为 。
(2)C→D的反应类型为_____________,G→H 的反应类型为_____________。
(3)D的结构简式为___________________,G的结构简式为_______________________。
(4)反应3的化学方程式为_______________________________________________________。
(5)J的核磁共振氢谱有__________个峰。
(6)化合物I有多种同分异构体,同时满足下列条件的结构有 种。
①能发生水解反应和银镜反应
②能与FeCl3溶液发生显色反应
③苯环上有四个取代基,且苯环上一卤代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下:
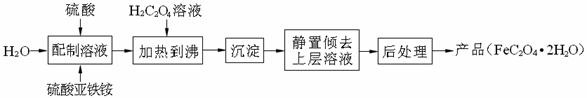
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量硫酸,目的是 。
(2)沉淀时发生反应的化学方程式为_____________________________________________________。
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成。这说明草酸亚铁晶体具有_________(填“氧化”或“还原”)性。若反应中消耗1mol FeC2O4·2H2O,则参加反应的n(KMnO4)为__________。
(4)三草酸合铁酸钾晶体K3[Fe(C3O4 )3]·3H2O
(5)称取3.60g草酸亚铁晶体(摩尔质量是180g·mol-1)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
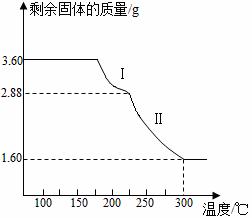
①过程Ⅰ发生反应的化学方程式为 。
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式 (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述的实验能达到预期目的的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 滴定实验中,用待测液润洗锥形瓶2~3次 | 避免造成实验误差 |
| B | 向氯水中滴加AgNO3、稀HNO3溶液,产生白色沉淀 | 验证氯水中含有Cl- |
| C | 向盛有沸水的烧杯中滴加饱和氯化铁溶液并长时间煮沸 | 制备氢氧化铁胶体 |
| D | 向2 mL 1 mol·L-1 NaOH溶液中先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1 FeCl3溶液 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
把含硫酸铵和硝酸铵的混合液2a L分成两等份。一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3- 的浓度为 ( )
A 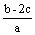 B
B 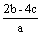 C
C 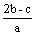 D
D 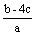
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com