
【题目】关于下列各实验装置的叙述中,不正确的是( )

A. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C. 装置①可用于分离C2H5OH和H2O的混合物
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】![]() ,加水稀释
,加水稀释![]() 的氨水,下列判断正确的是
的氨水,下列判断正确的是
A.原氨水的浓度![]()
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中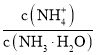 的增大
的增大
D.再加入![]() 的盐酸,混合液
的盐酸,混合液![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:![]()
反应II:![]()
写出NO分解生成![]() 与
与![]() 的热化学方程式______。
的热化学方程式______。
(2)在恒温恒容装置中充入一定量的![]() 和
和![]() ,在某催化剂的作用下进行反应I,测得不同时间的
,在某催化剂的作用下进行反应I,测得不同时间的![]() 和
和![]() ,的浓度如表:
,的浓度如表:
时间 | 0 | 5 | 10 | 15 | 20 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
则下列有关叙述中正确的是______。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
C.当容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
D.前10分钟内的平均速率![]()
![]()
(3)氨催化氧化时会发生上述两个竞争反应I、![]() 为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol![]() 和2mol
和2mol![]() ,测得有关物质的量关系如图1:
,测得有关物质的量关系如图1:

①该催化剂在低温时选择反应______![]() 填“I”或“II”
填“I”或“II”![]() 。
。
②![]() 时,
时,![]() 的平衡常数
的平衡常数![]() ______
______![]() 不要求得出计算结果,只需列出数字计算式
不要求得出计算结果,只需列出数字计算式![]() 。
。
③![]() 点比B点所产生的NO的物质的量少的主要原因______。
点比B点所产生的NO的物质的量少的主要原因______。
(4)合成氨工业会产生大量副产物![]() ,工业上常用高浓度的
,工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使![]() 溶液再生,其装置如图2所示:
溶液再生,其装置如图2所示:
①在阳极区发生的反应包括______和![]() 。
。
②简述![]() 在阴极区再生的原理______。
在阴极区再生的原理______。
(5)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的![]() 。
。
已知:![]() 时,
时,![]() ,
,![]() ,
,![]()
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则![]() 氢硫酸的
氢硫酸的![]() ______
______![]() 取近似整数
取近似整数![]() 。
。
②已知,某废液接近于中性,若加入适量的氢硫酸,当废液中![]() ______
______![]() 计算结果保留两位有效数字
计算结果保留两位有效数字![]() ,就会产生CuS沉淀。
,就会产生CuS沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A. 将过量氨气通入CuSO4溶液中可得深蓝色溶液
B. 蛋白质溶于水所得分散系可产生丁达尔效应
C. 硅酸钠溶液与稀盐酸反应可生成硅酸胶体
D. 过量铁粉在氯气中燃烧可生成氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应Ⅰ的化学方程式为2C+SiO2 ![]() Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2 ![]() Si+CO2↑(碳不足)和______(碳足量)。
Si+CO2↑(碳不足)和______(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 |
|
|
| HCl |
|
|
质量分数 |
|
|
|
|
|
|
沸点 |
|
|
|
|
|
|
图中“操作X”的名称为______;![]() 的电子式为______。
的电子式为______。
(3)反应Ⅳ的化学方程式为3SiCl4+4NH3 ![]() Si3N4+12HCl,若向2L恒容密闭容器中投入1mol
Si3N4+12HCl,若向2L恒容密闭容器中投入1mol![]() 和1mol
和1mol![]() ,6min后反应完全,则
,6min后反应完全,则![]() min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气
min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气![]() 和
和![]() 在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种物质![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 组成一个化学方程式,已知
组成一个化学方程式,已知![]() 等三种物质为反应物,
等三种物质为反应物,![]() 难溶于水.下列判断正确的是
难溶于水.下列判断正确的是![]()
A.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
B.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
C.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
D.![]() 是反应物;
是反应物;![]() 是生成物
是生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Mg投入稀HNO3中:Mg+2H+=Mg2++H2↑
B.MnO2与浓盐酸混合加热制Cl2:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.向稀H2SO4和H2O2的混合液中加入Cu粉:2H++H2O2+Cu=Cu2++2H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO![]() +2H2O+4NH
+2H2O+4NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y用于一种抗心律失常药的合成,可由化合物X在一定条件下制得。下列有关化合物X、Y的说法正确的是

A.X分子中所有原子可能在同一平面内
B.1 mol Y最多能与4 mol H2发生加成反应
C.X→Y的反应类型为加成反应
D.用FeCl3溶液可检验Y中是否含有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是
A.X的最高价氧化物对应的水化物一定为强酸B.气态氢化物的沸点:Y>M
C.Z是地壳中含量最多的元素D.原子半径:Z>M>X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com