
| A. | 64 | B. | 32 | C. | 96 | D. | 124 |
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
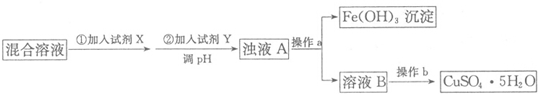
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 6.5 | 4.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 1:6 | C. | 2:3 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 | |
| C. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 | |
| D. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,用细沙覆盖灭火 | |
| B. | 金属钠与氧气反应,条件不同,产物不同 | |
| C. | Na的化学性质比镁活泼,故用Na与MgCl2溶液反应制取金属镁 | |
| D. | 9.2g金属钠与足量水反应,反应过程中有0.4mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com