
(本题共16分)磷矿石的主要成分是Ca5F(PO4)3,含少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4的常用流程如下:

已知:Ca5F(PO4)3+ 7H3PO4→5Ca (H2PO4)2+HF
(1)采用这种方法在实验室溶解磷矿石________(填“能”或“不能”)用玻璃仪器,原因是_____________________________________。
(2)操作Ⅰ的名称是___________
(3)在实验室中实现操作Ⅱ和Ⅲ所需要的玻璃仪器有_______________________,推测该萃取剂一定具有的性质是_________。
a. 该萃取剂与水互不相溶 b. 相同条件下,该萃取剂的密度比水小
c. 磷酸在该萃取剂中的溶解度很小 d. 某些磷酸二氢盐在该萃取剂中的溶解度很小
(4)采用该流程除制取磷酸外,还有__________________等副产品产生,请说出其中一种副产品的用途____________________________________。
(5)与直接用硫酸溶解磷矿石的工艺相比,该工艺的优点是____________________。
(本题共16分)(1)不能;HF会腐蚀玻璃 (2)过滤;
(3)分液漏斗、烧杯; a、d(各1分,共2分)
(4)氟化氢、石膏;(用途略,只要答出氟化氢或氢氟酸或石膏的任一用途均可)
(5)磷矿石更易溶解
【解析】(1)由于HF会腐蚀玻璃能腐蚀玻璃,所以不能用玻璃仪器。
(2)从溶液中分离出固体的方法是过滤,所以得到石膏的方法是过滤。
(3)萃取的主要玻璃仪器是分液漏斗和烧杯;萃取剂应该满足的体积是和原溶剂不互溶,且被萃取的物质在该萃取剂者的溶解度大于原溶剂中的溶解度,所以答案选ad。
(4)根据流程图可知,所得副产品是氟化氢和石膏。氟化氢可用于雕刻玻璃,石膏可用于工业建筑等。
(5)根据流程图及原理可知,该工艺的优点是磷矿石更易溶解。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4•2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO•bFeO•cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O→ 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO29.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若流量比为y,请通过计算列出y与x的关系式。
查看答案和解析>>
科目:高中化学 来源:2012届上海市浦东新区高三下学期4月质量抽测化学试卷(带解析) 题型:填空题
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4?2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO?bFeO?cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O → 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO2 9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若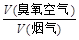 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省阜阳一中高三第一次月考化学试卷(带解析) 题型:实验题
(本题共16分)磷矿石的主要成分是Ca5F(PO4)3,含少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4的常用流程如下:
已知:Ca5F(PO4)3+ 7H3PO4→5Ca (H2PO4)2+HF
(1)采用这种方法在实验室溶解磷矿石________(填“能”或“不能”)用玻璃仪器,原因是_____________________________________。
(2)操作Ⅰ的名称是___________
(3)在实验室中实现操作Ⅱ和Ⅲ所需要的玻璃仪器有_______________________,推测该萃取剂一定具有的性质是_________。
a. 该萃取剂与水互不相溶 b. 相同条件下,该萃取剂的密度比水小
c. 磷酸在该萃取剂中的溶解度很小 d. 某些磷酸二氢盐在该萃取剂中的溶解度很小
(4)采用该流程除制取磷酸外,还有__________________等副产品产生,请说出其中一种副产品的用途____________________________________。
(5)与直接用硫酸溶解磷矿石的工艺相比,该工艺的优点是____________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三开学考试化学试卷(解析版) 题型:实验题
(本题共16分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
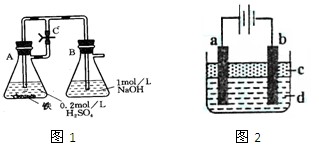
[实验设计]
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
|
资料名称 |
物理性质描述 |
化学性质描述 |
|
《化学辞典》,顾翼东编,1989年版P637 |
白色无定形粉末或白色至淡绿色六方晶体 |
与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
|
《大学普通化学(下册)》傅鹰著P637 |
白色沉淀 |
此沉淀易被氧化成微绿色Fe3(OH)8 |
|
《普通化学教程》(下册)P788 |
白色 |
能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com