
分析 (1)三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物;
(2)K3[Fe(CN)6]与三价铁离子不反应,Fe2+与铁氰化钾K3[Fe(CN)6]反应生成铁氰化亚铁沉淀;
(3)硫酸根离子的检验,需加盐酸排除碳酸根离子干扰,再加入BaCl2溶液,有白色不溶于稀硝酸的沉淀产生,证明该离子存在.
解答 解:(1)三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:KSCN溶液,Fe3++3SCN-=Fe(SCN)3;
(2)含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
故答案为:K3[Fe(CN)6];3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)硫酸根离子的检验:向溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生,然后滴加稀硝酸沉淀不消失,证明含有硫酸根离子;
故答案为:稀盐酸和氯化钡;Ba2++SO42-=BaSO4↓.
点评 本题考查常见阴离子的检验,难度中等.要注意掌握常见离子的检验方法,避免相同反应现象的干扰.


科目:高中化学 来源: 题型:实验题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
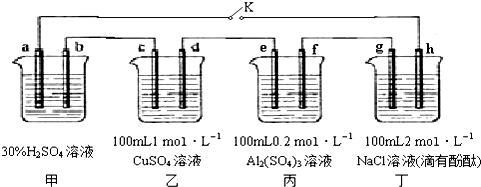
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸所有原子可能共平面 | |
| B. | 丙烯酸可以发生取代反应 | |
| C. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| D. | 丙烯酸与HBr发生加成反应只能得到唯一产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
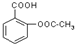 试根据阿斯匹林的结构回答;
试根据阿斯匹林的结构回答;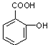 ,其分子式为C7H6O3,则B的结构简式为CH3COOH;
,其分子式为C7H6O3,则B的结构简式为CH3COOH;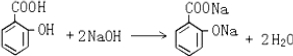 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、HCO3-、SO42-、Cl- | B. | CO32-、Cl-、K+、Na+ | ||
| C. | Na+、SO42-、CO32-、Cl- | D. | SO42-、Fe3+、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
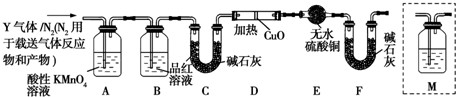
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用由CO2制备的聚碳酸酯降解塑料,可减少污染,实现碳的循环利用 | |
| B. | 铝合金因其密度小,硬度大,成为用量最大的合金 | |
| C. | 清洁燃料压缩天然气和液化石油气的主要成分是烃类 | |
| D. | 酱油加铁可以补充人体所需的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
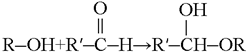 (产物统称半缩醛)
(产物统称半缩醛)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com