
| 起始浓度(mol/L) | 1.5 | 1.0 | 0 |
| 2s末浓度(mol/L) | 0.9 | 0.8 | 0.4 |
分析 (1)①根据浓度变化量之比等于化学计量数之比计算解答;②根据反应速率v=$\frac{△c}{△t}$计算;
(2)①氧化还原反应中电子转移数目即为电线中通过的电子,根据碳棒的反应2H++2e-=H2↑;
②根据生成的氢气计算出参加反应的H+的物质的量,计算出溶液中H+的物质的量浓度变化量,原稀硫酸溶液中H+的物质的量浓度减去溶液中H+的物质的量浓度变化量,即为所求溶液中H+的物质的量浓度.
解答 解:(1)aA(g)+bB(g)?2C(g)
起始浓度(mol/L) 1.5 1.0 0
变化浓度(mol/L) 0.6 0.2 0.4
2s末浓度(mol/L) 0.9 0.8 0.4
①浓度变化量之比等于化学计量数之比,则a:b:c=0.6:0.2:0.4=3:1:2,已知c为2,则a=3,b=1;
故答案为:3; 1
②2s内B的反应速率v=$\frac{0.2ml/L}{2s}$=0.1 mol•L-1•s-1;
故答案为:0.1 mol•L-1•s-1
(2)①碳棒上产生气体有$\frac{3.6L}{22.4L/mol}$=0.15mol,碳棒的反应为2H++2e-=H2↑;反应转移的电子的物质的量0.15mol×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023;
故答案为:1.806×1023
②原溶液为200mL 1.5mol•L-1的稀硫酸,H+:0.2L×1.5mol/L×2=0.6mol/L,由上问知反应H+反应了0.3mol,此时溶液中H+的物质的量为0.6mol-0.3mol=0.3mol,则H+的物质的量浓度为$\frac{0.3mol}{0.2L}$=1.5mol/L;
故答案为:1.5 mol•L-1
点评 本题考查化学平衡及反应速率计算、原电池、溶液计算等,综合较大,要求学生对基础知识熟练掌握并应用.


科目:高中化学 来源: 题型:选择题
| A. | 实验室蒸馏石油时,将温度计的水银球插入液面下 | |
| B. | 稀释浓硫酸时,将浓硫酸沿玻璃棒慢慢注入盛有水的烧杯内并不断用玻璃棒搅拌 | |
| C. | 用蒸发皿蒸发液体时,未垫上石棉网直接加热蒸发皿 | |
| D. | 配制一定物质的量浓度的溶液时,清洗后未经干燥的容量瓶直接用于实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
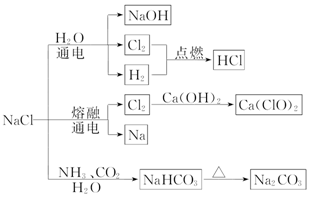
| A. | 25℃时,NaHCO3在水中的溶解度比 Na2CO3的大 | |
| B. | 石灰乳与 Cl2 的反应中,Cl2 既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的 Cl2 能用钢瓶贮运,所以 Cl2 不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mi n | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
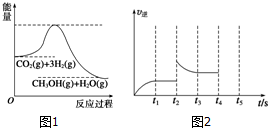
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
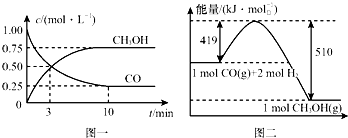 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
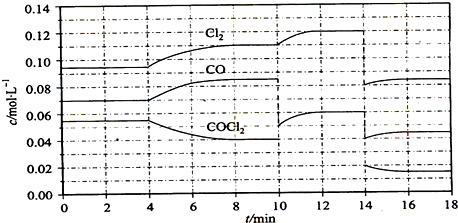
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
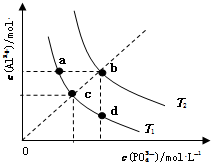
| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)→Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的CCl4溶液不能使干燥红色布条褪色 | |
| B. | 通过化学变化可以实现16O与18O间的相互转化 | |
| C. | 为了便于运输和使用,可以将液氯储存在钢瓶(主要成分为铁)中 | |
| D. | 700℃时,4Na+CCl4=C+4NaCl,该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
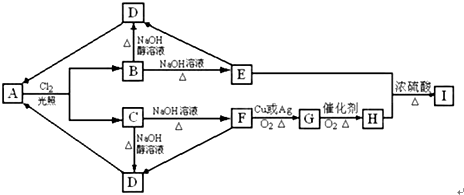
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com