
向500mL 2mol/L 的CuSO4溶液中插入一块铁片,反应片刻后取出铁片,经洗涤、烘干,称其质量比原来增重2.0g.下列说法错误的是(设反应后溶液的体积不变)()
A. 则此过程中参加反应的铁的质量是14g
B. 析出铜物质的量是0.25mol
C. 反应后溶液中溶质物质的量浓度:c(CuSO4)=1.5mol/L
D. 反应后溶液中溶质物质的量浓度:c(FeSO4)=1.5mol/L
考点: 化学方程式的有关计算.
专题: 计算题.
分析: 根据发生的反应为Fe+CuSO4═FeSO4+Cu,利用差量法来计算.
解答: 解:铁和硫酸铜反应方程式为:
Fe+CuSO4 ═FeSO4 +Cu△m
56g 1mol 1mol 1mol (64﹣56)g=8g
m(Fe) n(CuSO4) n(FeSO4 )n(Cu) 2g
A.m(Fe)=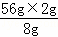 =14g,故A正确;
=14g,故A正确;
B.n(Cu)=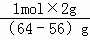 =0.25mol,故B正确;
=0.25mol,故B正确;
C.n(CuSO4)= =0.25mol,反应后剩余硫酸铜:0.5L×2mol/L﹣0.25mol=0.75mol,浓度为:
=0.25mol,反应后剩余硫酸铜:0.5L×2mol/L﹣0.25mol=0.75mol,浓度为: =1.5mol/L,故C正确;
=1.5mol/L,故C正确;
D.n(FeSO4 )=n(CuSO4)=0.25mol,c(FeSO4)=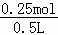 =0.5mol/L,故D错误;
=0.5mol/L,故D错误;
故选D.
点评: 本题考查学生利用化学反应方程式的计算,明确物质的质量变化及差量法来计算是解答本题的关键,难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
|
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
|
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
|
| D. | 如果某一基态3p能级上仅有2个电子,它们自旋方向必然相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2﹣具有相同的电子层结构,W与X同主族,下列说法正确的是()
A. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. Y分别与Z、W形成的化合物中化学键类型相同
C. X的最高氧化物对应的水化物的酸性比W的弱
D. Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或数据合理的是()
A. 用过滤的方法分离Fe(OH)3胶体和HCl溶液
B. 用托盘天平称取25.12gNaCl固体
C. 分别含有Mg2+、Cu2+和Na+的三种盐溶液,用NaOH溶液就能一次鉴别开
D. 从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数,下列说法中正确的是()
A. 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
B. 1mol氧元素组成的单质一定含有2NA氧原子
C. 在H2O2+Cl2=2HCl+O2反应中,毎生成32g氧气,则转移2NA个电子
D. 含NA个Na+的 Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1molNa2SO4溶于水能电离出 个Na+、 个SO42﹣.
(2) molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等.
(3)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数为 .该混合气体对氢气的相对密度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应前后物质的总能量变化可用如图表示的是()
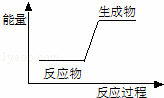
A. H﹣F═H+F B. Mg+2H+=Mg2++H2↑
C. 2Na+2H2O=2Na++2OH﹣+H2↑ D. HNO3+NaOH=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
元素代号 X Y Z W
原子半径/pm 160 143 75 74
主要化合价 +2 +3 +3、+5、﹣3 ﹣2
下列叙述正确的是()
A. Y的最高价氧化物对应的水化物显两性
B. 一定条件下,Z单质与W的常见单质直接生成ZW2
C. X、Y元素的金属性 X<Y
D. X2+离子半径大于W2﹣离子半径
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com