
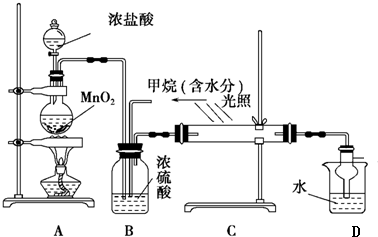
分析 实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生发现硬质玻璃管内壁有油珠附着,生成产物中分子量最大的物质为四氯化碳,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)MnO2能将HCl(浓)氧化为MnCl2和Cl2;被还原氯化氢是氯气的2倍;
(2)依据气体冒出速率可知反应速率,浓硫酸可以干燥氯气和氯化氢;
(3)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳,若理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代;
(4)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁有油珠附着,生成产物中分子量最大的物质为CCl4;
(5)装置中最后剩余的氯气、氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
(6)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷.
解答 解:(1)MnO2能将HCl(浓)氧化为MnCl2和Cl2,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥作用,
故答案为:控制气流速度;干燥混合气体;均匀混合气体;
(3)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设$\frac{V(C{l}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代,x应大于或等于4,故答案为:≥4;
(4)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁有油珠附着,生成产物中分子量最大的物质为CCl4,甲烷和氯气发生取代反应,反应的化学方程式为:CH4+4Cl2→CCl4+4HCl,
故答案为:CH4+4Cl2→CCl4+4HCl;
(5)装置中最后剩余的氯气、氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,故答案为:BCD.
(6)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
一氯甲烷是气体,还可能有过量的甲烷,所以尾气的主要成分是可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液; ①②.
点评 本题考查氯气的制备以及甲烷与氯气的取代反应,掌握反应的原理、准确把握产物的判断是答题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| A. | 放出248 kJ 热量 | B. | 吸收248 kJ 热量 | C. | 放出183kJ 热量 | D. | 吸收183 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
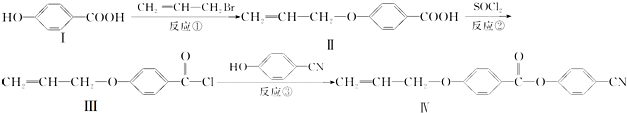
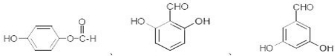 .
.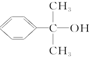 也可与化合物Ⅲ发生类
也可与化合物Ⅲ发生类 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com