
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+ H2(g)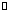 HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
A. 正反应速率
B. 逆反应速率
C. HCOOH(g)的浓度
D. H2的体积分数
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是 ( )
A. n=m+10 B. n=m+11
C. n=m+25 D. n=m+1
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
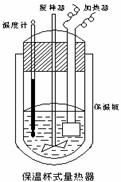 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
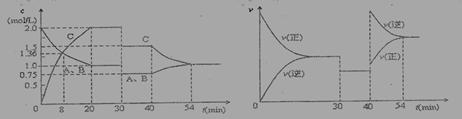
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
.一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
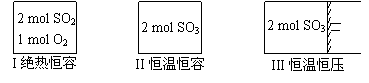

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.SO3的体积分数:II>III
D.容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列关于实验现象的描述正确的是 ( )
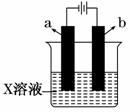
| a电极 | b电极 | X溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
| C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
| D | 石墨 | 石墨 | HCl | a电极放出无色气体,b电极放出无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按如下图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是 ( )

A.甲池中,Cu极上有气泡放出
B.发现a点附近显红色
C.在C1、C2电极上所产生气体的体积比为2∶1
D.乙池溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险.由于人体体液的缓冲系统中存在如下平衡:
H++HCO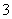
 H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO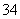
 HPO
HPO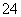
H++HPO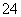
 H2PO
H2PO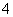
故能维持血液pH的相对稳定,以保证正常生理活动.下列说法中不合理的是 ( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com