
下列各组性质的比较中正确的是()
A. 酸性:HClO4<H2SO4<H3PO4 B. 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C. 稳定性:HF>HCl>PH3>H2S D. 原子半径:O>S>Na
考点: 非金属在元素周期表中的位置及其性质递变的规律;金属在元素周期表中的位置及其性质递变的规律;微粒半径大小的比较.
专题: 元素周期律与元素周期表专题.
分析: A、根据元素的非金属性越强,其对应的最高价氧化物对应的水化物的酸性越强解答;
B、金属性越强,最高价氧化物的水化物的碱性越强,可以据此解答该题;
C、非金属性越强,气态氢 化物越稳定,可以据此解答该题;
化物越稳定,可以据此解答该题;
D、同一周期元素中,原子半径随着原子序数的增大而减小,同一主族元素中,原子半径随着原子序数的增大而增大.
解答: 解:A、因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>P,酸性:H3PO4<H2SO4<HClO4,故A错误;
B、金属性越强,最高价氧化物的水化物的碱性越强,金属性顺序:Ba>Ca>Mg,所以碱性强弱顺序为:Ba(OH)2>Ca(OH)2>Mg(OH)2,故B正确;
C、非金属性越强,气态氢化物越稳定,非金属性F>Cl>S>P,则氢化物稳定性为HF>HCl>H2S>PH3,故C错误;
D、同一周期元素中,原子半径随着原子序数的增大而减小,同一主族元素中,原子半径随着原子序数的增大而增大,则原子半径:O<S<Na,故D错误.
故选B.
点评: 本题考查熔沸点的比较、非金属和金属性的比较,明确常见的比较的方法是解答本题的关键,注意知识的归纳整理,题目难度不大.


科目:高中化学 来源: 题型:
下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是()
A. 增大浓度 B. 增大压强 C. 升高温度 D. 使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
取1.43g Na2CO3•10H2O溶于水配成100mL溶液,求:
(1)Na2CO3溶液的物质的量浓度
(2)Na+物质的量浓度
(3)取出20ml该溶液用水稀释,使Na2CO3溶液的物质的量浓度变为0.004mol/L,求加入水的体积(设稀释时,对溶液体积的影响忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程.

下列有关说法正确的是()
A. 制取NaHCO3的反应是利用其溶解度小于NaCl
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
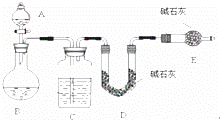
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
【方法一】测 SO2质量法采用如图所示装置,通过实验测定生成SO2的质量.
(1)C中盛放的试剂是 ,E装置的作用是
(2)若实验前称取m1g样品,再测得SO2的质量为m2g,则可得Na2SO4质量分数,其中m2是通过测定 (填装置符号)装置在实验前后的质量差得到的.该方法的缺点是(只答一点).
【方法二】测沉淀质量法
第一步:称取m3g样品,置于小烧杯中 第二步:向小烧杯中加入足量稀盐酸,加热
第三步:再向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤 第四步:干燥沉淀,称重为m4g
(3)简述洗涤沉淀的方法: .
(4)若m3=2m4 则试样中Na2SO4的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,合成氨反应N2(g) +3H2(g)⇌2NH2(g)△H=﹣92.0kj•mol﹣1,将此温度下的lmol N2和3mol 放在一密闭容器中,在催化剂存在时进行反应.测得反应放出的热量为(假定测量过程中没有能量损失)()
+3H2(g)⇌2NH2(g)△H=﹣92.0kj•mol﹣1,将此温度下的lmol N2和3mol 放在一密闭容器中,在催化剂存在时进行反应.测得反应放出的热量为(假定测量过程中没有能量损失)()
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是()
M N P
A 锌 铜 稀硫酸溶液
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
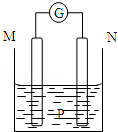
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L﹣1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是()
A. 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大
B. 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42﹣)>c(HC2O4﹣)>c(H+)
C. 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)
D. 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是()
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com