
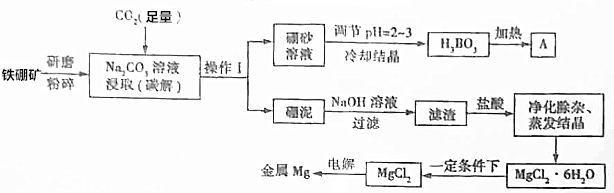
分析 铁硼矿的主要成分为Mg2B2O5•H2O和Fe3O4,含有少量Al2O3和SiO2等,碳解得到硼砂溶液(Na2B4O7•10H2O),过滤分离,碳解发生反应:2Mg2B2O5•H2O+Na2CO3+3CO2=Na2B4O7+2H2O+4MgCO3.硼砂溶液调节pH得到硼酸,加热分解得到A为B2O3.硼泥中含有MgCO3、Fe3O4、Al2O3、SiO2等,加入氢氧化钠溶液,Al2O3、SiO2溶解,滤渣中含有MgCO3、Fe3O4,再用盐酸溶解,得到溶液中含有MgCl2、FeCl2、FeCl3,加H2O2溶液将亚铁离子氧化为铁离子,再调节溶液pH,使铁离子转化为氢氧化铁沉淀过滤除去,滤液经过蒸发浓缩、冷却结晶得到MgCl2•6H2O,为防止氯化镁水解,在HCl环境下加热失去结晶水,最后电解熔融氯化镁得到Mg.
(5)A.根据电荷守恒判断;
B.Na[B(OH)4]溶液溶液呈碱性;
C.根据物料守恒判断.
解答 解:铁硼矿的主要成分为Mg2B2O5•H2O和Fe3O4,含有少量Al2O3和SiO2等,碳解得到硼砂溶液(Na2B4O7•10H2O),过滤分离,碳解发生反应:2Mg2B2O5•H2O+Na2CO3+3CO2=Na2B4O7+2H2O+4MgCO3.硼砂溶液调节pH得到硼酸,加热分解得到A为B2O3.硼泥中含有MgCO3、Fe3O4、Al2O3、SiO2等,加入氢氧化钠溶液,Al2O3、SiO2溶解,滤渣中含有MgCO3、Fe3O4,再用盐酸溶解,得到溶液中含有MgCl2、FeCl2、FeCl3,加H2O2溶液将亚铁离子氧化为铁离子,再调节溶液pH,使铁离子转化为氢氧化铁沉淀过滤除去,滤液经过蒸发浓缩、冷却结晶得到MgCl2•6H2O,为防止氯化镁水解,在HCl环境下加热失去结晶水,最后电解熔融氯化镁得到Mg.
(1)铁硼砂“研磨粉碎”的目的是:增大接触面积,提高反应速率,操作Ⅰ为过滤,硼泥中含有MgCO3、Fe3O4、Al2O3、SiO2等,“硼泥”中除杂质SiO2和Al2O3外,其他成分为MgCO3、Fe3O4,
故答案为:增大接触面积,提高反应速率;过滤;MgCO3、Fe3O4;
(2)流程图中“碳解”过程的化学方程式:2Mg2B2O5•H2O+Na2CO3+3CO2=Na2B4O7+2H2O+4MgCO3,金属Mg与A反应制备硼的化学方程式为:3Mg+B2O3$\frac{\underline{\;一定条件\;}}{\;}$2B+3MgO,
故答案为:2Mg2B2O5•H2O+Na2CO3+3CO2=Na2B4O7+2H2O+4MgCO3;3Mg+B2O3$\frac{\underline{\;一定条件\;}}{\;}$2B+3MgO;
(3)碳碱法工艺需两次调节pH:①常用H2SO4溶液调节pH=2~3制取H3BO3,其离子方程式为:B4O72-+2H++5H2O=4H3BO3↓,②制取MgCl2•6H2O的“净化除杂”过程中,需先加H2O2溶液,其作用是:将Fe2+氧化为Fe3+,然后用MgO调节pH约为5,其目的是:使Fe3+水解转化为Fe(OH)3,
故答案为:B4O72-+2H++5H2O=4H3BO3↓;将Fe2+氧化为Fe3+;使Fe3+水解转化为Fe(OH)3;
(4)MgCl2•6H2O制取MgCl2过程中为防止MgCl2水解需在“一定条件下”,则该条件是指:HCl气体氛围下,
故答案为:HCl气体氛围下;
(5)A.c(Na+)+c(H+)=c{[B(OH)4]-}+c(OH-),符合电荷守恒,故A正确;
B.Na[B(OH)4]溶液溶液呈碱性,应为c(Na+)>c{[B(OH)4]-}>c(OH-)>c(H+),故B错误;
C.由Na、B物质的量1:1可知,c(Na+)=c{[B(OH)4]-}+c(H3BO3),故C正确,
故选:AC.
点评 本题考查物质制备工艺流程,涉及物质的分离与提纯、对原理与条件控制分析、盐类水解等,关键是对工艺流程理解,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤 | |
| B. | 定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切 | |
| C. | 洗涤量筒,并将洗涤液转入容量瓶 | |
| D. | 定容时仰视读数. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
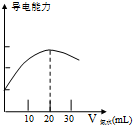 某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:
某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com